Triptófano y sus metabolitos

Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de Madrid. Investigadora del Centro de Estudios Gregorio Marañón.
El triptófano (TPRF) es un aminoácido esencial (el organismo no puede sintetizarlo) que debe ser incorporado mediante la dieta (1,2), a través de alimentos ricos en proteínas, como la carne, pescado, queso, productos lácteos, huevos, leche, tofu y soja, etc. (3,4). La cantidad recomendada de TRPF para los adultos se sitúa entre los 3,5-6 mg/kg/día, aproximadamente 300 mg de TRPF al día para un adulto (3,5).
En cuanto a sus funciones, el TRPF está implicado en la síntesis de proteínas además de ser el precursor de metabolitos como la quinurenina (QUIN), el ácido quinurénico (AQUIN) y la serotonina (5-HT) (1).
ABSORCIÓN Y TRANSPORTE DEL TRIPTÓFANO
De toda la cantidad de TRPF que entra en el organismo, solamente una parte de este alcanza la circulación portal tras su absorción en el intestino. Según (5), el TRPF logra su mayor concentración en el colon distal, que es donde se lleva a cabo la mayor parte de la degradación proteica. A continuación, se metaboliza en el hígado, para, seguidamente, pasar a la circulación sistémica (3). En este punto, la mayor parte de TRPF se une a la albúmina (aproximadamente un 80-90%) mientras que el resto se queda en forma libre (2). Una dieta pobre en TRPF provocaría la activación de la síntesis de proteínas hepáticas, consumiéndose en primer lugar el TRPF disponible en plasma (6). Los productos de degradación que salen del hígado van a la circulación periférica y después son transportados a otros órganos, como el cerebro, corazón y músculo esquelético. El TRPF que no ha sido metabolizado será utilizado por la microbiota intestinal (7,8)
Para el transporte del triptófano se emplea un sistema de transporte denominado LAT1 (de sus siglas en inglés, L-Amino acid Transporter-1), que también se encarga de conducir otros aminoácidos esenciales (leucina, isoleucina, fenilalanina, metionina, histidina, valina y tirosina) (9–11), por lo que el TRPF compite con estos por la unión al transportador (7,12). LAT1 lleva los aminoácidos esenciales hacia las células a cambio de la salida de sustratos (como la glutamina o los aminoácidos esenciales de cadena ramificados), por lo que también actúa como antiportador (10,13). Dentro de la familia LAT1, destaca un transportador de membrana, SLC7A5, que es independiente del pH y del sodio y se expresa en células que necesitan de un aporte continuo de aminoácidos, como las células neurales, gliales, placentarias o células endoteliales de la barrera hematoencefálica (BHE) (10). Gracias a que LAT1 se sitúa en las células neuronales, el TRPF es capaz de atravesar la BHE (14) sin ningún problema, aunque debe competir con el resto de aminoácidos neutros, como por ejemplo los aminoácidos de cadena ramificada (de sus siglas en inglés, BCAAs), que serán expuestos en otro apartado. Si existe una disminución en la concentración de BCAAs plasmáticas, la cantidad de TRPF libre que entra en el cerebro será mayor (Yamashita, 2020).
Según la evidencia científica, la ingesta en una comida de hidratos de carbono (HC) junto a una fuente proteica (que contenga TRPF) provoca que la insulina se accione y dirija al resto de aminoácidos que no son el TRPF al tejido muscular, permaneciendo este en circulación sanguínea (2). De esta manera, la concentración de aminoácidos que se encontraban en circulación y podían competir con el TRPF por su unión a la albumina disminuye provocando que la disponibilidad del TRPF aumente e ingrese más rápido en el cerebro (Gostner et al., 2020; Strasser & Fuchs, 2016).
METABOLISMO DEL TRIPTÓFANO
El metabolismo detallado del TRPF tiene lugar a través de tres vías.
1.Vía de la quinurenina
La vía de la quinurenina (QUIN) se encarga de la degradación de aproximadamente el 95% de TRPF en el hígado (17). Está controlada por las enzimaslimitantes de la velocidad indoleamina 2,3-dioxigenasa (IDO) y Trp 2,3-dioxigenasa (TDO) y finaliza con la producción de nicotinamina adenina dinucleótido (NAD) (Figura 1) (1,3,15,18–25). Estas dos enzimas se encargan de catabolizar el paso de TRPF a QUIN pero difieren en ciertos aspectos.
Por un lado, la TDO es una enzima tetramérica específica del hígado (aunque presenta una mínima expresión en el cerebro (18) que se encarga de degradar el TRPF que procede de la dieta (26). Una vez que el TRPF es absorbido en las células del intestino, llega al hígado donde se metaboliza por la TDO. La cantidad de TRPF que no es catabolizado por esta enzima difunde a la circulación sanguínea con el objetivo de estar disponible para los tejidos periféricos (27). Se ha visto que los glucocorticoides inducen la expresión de la TDO (2).
Por otro lado, la IDO es una enzima monomérica que se expresa en cerebro, tracto gastrointestinal (TGI) y riñones (órganos inmunitarios e inflamatorios) e interviene en la regulación de la inmunidad (2,18,26). Existen dos isoformas de la IDO; la IDO 1 que se expresa en casi todas las células extrahepáticas y la IDO 2, de descubrimiento reciente, por lo que aún se desconoce su papel, aunque se sabe que metaboliza el TRPF con una actividad enzimática menor a la de la IDO 1 (28). A este respecto, siempre que hablemos de IDO, nos referiremos a la IDO 1. Las citocinas proinflamatorias (interferón-gamma (IFN-γ), el factor de necrosis tumoral alfa (TNF-α), el receptor tipo Toll 4 (TLR4) y el receptor de interleuquina 1β (IL-1R) son los principales inductores de esta enzima (2,17,24,29), mientras que el óxido nítrico es un inhibidor (28). Además, se ha visto que los ácidos grasos de cadena corta (AGCC) que surgen de la microbiota, concretamente el butirato, alteran la expresión de la IDO, dando como resultado una reducción de la producción de QUIN (2). Como consecuencia, la actividad de la IDO se ha relacionado con la inflamación, por lo que es normal medir la relación QUIN/TRPF en enfermedades en las que existe un proceso inflamatorio de fondo, como las enfermedades cardiovasculares, el cáncer, la obesidad… (1,3,29). Por ello, en condiciones inflamatorias, la IDO presenta una actividad mayor a la TDO y la vía de la QUIN se encuentra altamente activada metabolizando TRPF, lo que conduce a una disponibilidad disminuida del aminoácido de manera constante y a una menor síntesis de 5-HT (30). En cambio, en condiciones normales, es la TDO la enzima protagonista y la encargada de catabolizar el primer paso de la degradación del TRPF en el hígado (3).
Finalmente, conocemos que la TDO presenta una reducida actividad enzimática en el músculo esquelético, de lo que se deduce que la mayor parte de QUIN se producirá en el hígado por medio de esta enzima, o en las células inmunitarias (por parte de la IDO) y luego se transporta a la fibra muscular (9). Sin embargo, según el estudio de (26), la TDO sufre una degradación en el hígado, mientras que la IDO continúa con su actividad enzimática normal, por lo que los niveles de QUIN que se observan en plasma proceden de esta ruta enzimática. En este aspecto, conviene remarcar la importancia de proponer la relación QUIN/TRPF con la finalidad de conocer la actividad de la IDO, ya que parece ser la más influyente en esta conversión enzimática. Además, también se ha visto que un nivel elevado de TRPF en sangre contribuye a una estabilización de la conformación de la TDO, estando el aminoácido disponible para ser degradado por la vía de la QUIN, mientras que los niveles bajos de TRPF desencadenan la poliubiquitinacion de la TDO, impidiendo el catabolismo del TRPF. Así pues, sería recomendable que la concentración plasmática de TRPF fuera constante, pero esto resulta complicado teniendo en cuenta que este aminoácido es suministrado a través de la dieta.
Como hemos señalado anteriormente, la TDO y la IDO dan lugar a la formación de QUIN, que a su vez sigue metabolizándose en otros productos, como el AQUIN (AQUIN) (por acción de la QUIN aminotransferasa, QUINAT) (31). La QUINAT cuenta con 4 isoformas en hígado, cerebro y músculo esquelético (QUINAT I, II, III y IV) (32). El AQUIN es un compuesto neuroprotector antagonista del receptor de N-metil D-aspartato (NMDA) (17,33,34) cuyas cantidades producidas son mínimas (10 µmol/día) ya que, en su mayoría, la vía de la QUIN se dirige hacia la síntesis de ácido quinolínico y NAD+ (34,35). El AQUIN está implicado en procesos fisiológicos y patológicos de trastornos funcionales cerebrales y gastrointestinales. Además, parece desempeñar funciones antioxidantes, ya que es capaz de eliminar las especies reactivas de oxígeno (ROS) y reducir la inflamación (19). No obstante, según señalan (19), los niveles bajos de AQUIN pueden promover el daño tisular y el incremento de las células inflamatorias en enfermedades neurodegenerativas, por lo que habría que tener en consideración los niveles de triptófano como precursor del AQUIN en el cerebro, ya que a diferencia del TRPF y la QUIN, el AQUIN no puede atravesar la BHE debido a su condición impermeable (8,19,36).
2.Vía de la hidroxilación
La vía minoritaria por la que se metaboliza el TRPF (alrededor del 1-2%), se denomina vía de la hidroxilación, en la que se sintetiza el neurotransmisor serotonina (5-hidroxitriptamina, 5-HT) (3,31,37). Esta reacción es catalizada por la enzima triptófano hidroxilasa (TpH) y existe en dos isoformas; la TpH1 que se expresa en las células enterocromafines (CE) del epitelio intestinal y la TpH2 que se produce en las neuronas serotoninérgicas del SNC y Sistema Nervioso Entérico (SNE) (2,6,38,39). Por ello, la síntesis de 5-HT tiene lugar a nivel cerebral o a nivel periférico. No obstante, la mayoría de 5-HT (más del 90%) (40) es sintetizada en las CE del intestino y a partir de ahí es captada por las plaquetas y entra en la circulación sistémica (39). Por tanto, la serotonina periférica no alcanza el Sistema Nervioso Central (SNC) porque no puede atravesar la BHE (39,41,42). Además, es rápidamente metabolizada al ácido 5-hidroxiindolacético (43). Por otro lado, el transportador de recaptación selectiva de 5-HT (SERT; codificado por el gen SLC6A4) de las células epiteliales intestinales se encarga de eliminar la 5-HT del espacio intersticial una vez que ha sido producida por las CE (36), si bien esa recaptación de 5-HT parece ser muy poco efectiva, por lo que las plaquetas que se encuentran circulando por la lámina propia captan la 5-HT que resulta de este proceso almacenándola y transportándola a tejidos periféricos. Además, estas plaquetas son capaces de promover la expresión de receptores de 5-HT que favorezcan la agregación plaquetaria (44), mientras que el tromboxano A2 o el adenosin difosfato (ADP) contribuyen a que la 5-HT active las plaquetas (2). En conclusión, la síntesis cerebral de 5-HT depende de la disponibilidad que exista de su precursor, el TRPF, y, a su vez, de la competencia de éste con otros aminoácidos por la unión al transportador LAT1 (1).
En este sentido, persiste la duda de si el nivel plasmático de 5-HT correlaciona con el nivel sináptico. Debido a la gran dificultad existente en medir directamente el nivel de 5-HT de la hendidura sináptica, aun no se ha podido establecer dicha asociación, por lo que los investigadores llevan a cabo estudios sobre el nivel de 5-HT en aquellos fluidos biológicos más accesibles, como el plasma, suero o incluso plaquetas (45). Además, es importante tener en cuenta la influencia de la microbiota en los niveles (intestinal y circulante) de 5-HT, ya que distintos metabolitos microbianos pueden ejercer un efecto modulador sobre la síntesis de 5-HT en las CE. De hecho, la 5-HT es considerada un neurotransmisor, capaz de transmitir señales desde el intestino a las neuronas del sistema nervioso, actuando como una hormona que conecta el eje intestino-cerebro (6,36,40).
Por otra parte, la 5-HT sintetizada en el intestino es liberada en respuesta a la contracción del TGI (40) entrando en el torrente circulatorio para ejercer sus acciones, como la regulación del tono vascular, la hemostasia primaria o la motilidad intestinal. De hecho, la 5-HT periférica desempeña un rol clave como una hormona capaz de modular el metabolismo periférico. En respuesta al ayuno, la serotonina se eleva como resultado de la regulación al alza de la expresión de la TpH1, promoviendo la lipólisis de los adipocitos y aportando sustratos para la gluconeogénesis del hígado (40). En cambio, la 5-HT que alcanza el SNC, se encarga del control del estado de ánimo, de la ingesta de alimentos, la ansiedad o el sueño (3).
3.Vía de los indoles. Producción de triptófano y sus metabolitos por la microbiota
Además de las dos vías comentadas por las que el TRPF puede ser degradado, existe una tercera ruta protagonizada por los microorganismos del intestino (vía de los indoles). Constituye el 5% del metabolismo del TRPF (2,27,46). Algunas bacterias que pertenecen a la microbiota intestinal son capaces de transformar el TRPF en triptamina y metabolitos indoles gracias a que expresan enzimas responsables de la degradación del TRPF, como la triptofanasa y la descarboxilasa. Los indoles presentan funciones en la homeostasis metabólica y en la estimulación del sistema inmunitario, además de que algunos de estos, como la triptamina, ayudan a mantener la integridad de la barrera intestinal gracias a la activación del receptor arilo de hidrocarburos (de sus siglas en inglés AhR, Aryl hydrocarbon Receptor) (3,4,27). El AhR es un factor de transcripción (al que se le unen ciertos ligandos) que regula la expresión génica de ciertas enzimas, además de encargarse de las señales ambientales, tóxicas, dietéticas e influir en la inmunidad y diferenciación celular (8,19,47,48). Al AhR se le unen ligandos, como la QUIN o el AQUIN que estimulan su expresión (17) y reducen la inflamación, permitiendo que el sistema inmune detecte de manera temprana las células malignas que podrían dar lugar a la aparición de algún tipo de cáncer (48)
La microbiota intestinal que se encuentra en el intestino grueso y es capaz de degradar el TRPF, determina, por tanto, la cantidad de este aminoácido que pasará a circulación portal, además de limitar la disponibilidad del mismo para el huésped (49). Por consiguiente, también los niveles de 5-HT cerebrales se verán afectados (8,49,50)
Es importante señalar que cualquier alteración en la relación huésped-microbiota podría iniciar el desarrollo de ciertas patologías. Por ejemplo, un desajuste en la relación QUIN/indoles se relaciona con la afectación en enfermedades como la obesidad y la enfermedad celíaca (3)
En definitiva, la microbiota intestinal interactúa con el sistema nervioso central y el sistema nervioso entérico (también denominado sistema nervioso intrínseco) a través del eje bidireccional intestino-cerebro. Esto quiere decir que el intestino contribuye a la función y comportamiento del cerebro y que este mismo, modula ciertos aspectos del TGI, como la movilidad, la secreción o la absorción (6,51–55)
Desde otro punto de vista, la microbiota también es capaz de producir 5-HT aunque aún no están dilucidados los mecanismos por los que ésta se sintetiza. Se han sugerido dos posibilidades: en primer lugar, los ácidos grasos de cadena corta (AGCC) pueden indicar la producción de 5-HT a las CE estimulando la expresión de TpH1 y, en segundo lugar, la microbiota es capaz de emplear el TRPF luminal para la síntesis de 5-HT (14,36,51,56). De hecho, aproximadamente el 20% del microbioma intestinal posee enzimas capaces de sintetizar 5-HT, como la Candida, Streptococcus, Escherichia y Enterococcus (8,14).
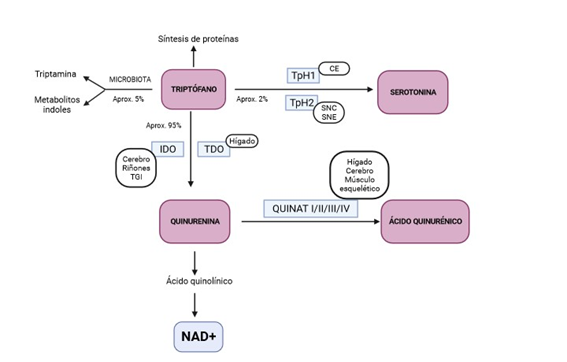
Figura 1. Metabolismo del triptófano, del que se derivan la vía de la quinurenina y la vía de producción de serotonina. TpH1, triptófano hidroxilasa 1; TpH2, triptófano hidroxilasa 2; SNC, Sistema Nervioso Central; SNE, Sistema Nervioso Entérico; CE, células enterocromafines; IDO, Indoleamina 2,3-dioxigenasa; TDO, triptófano 2,3-dioxigenasa; QUINAT, quinurenina aminotransferasa. Adaptado a partir de los trabajos de (8) y (27). Creado con BioRender.
BIBLIOGRAFÍA:
1. Kałużna-Czaplińska J, Gątarek P, Chirumbolo S, Chartrand MS, Bjørklund G. How important is tryptophan in human health? Crit Rev Food Sci Nutr. 2019;59(1):72–88.
2. Roth W, Zadeh K, Vekariya R, Ge Y, Mohamadzadeh M. Tryptophan metabolism and gut-brain homeostasis. Int J Mol Sci. 2021;22(6):1–23.
3. Melhem NJ, Taleb S. Tryptophan: From diet to cardiovascular diseases. Int J Mol Sci. 2021;22(18).
4. Roager HM, Licht TR. Microbial tryptophan catabolites in health and disease. Nat Commun [Internet]. 2018;9(1):1–10. Available from: http://dx.doi.org/10.1038/s41467-018-05470-4
5. Grifka-Walk HM, Jenkins BR, Kominsky DJ. Amino Acid Trp: The Far Out Impacts of Host and Commensal Tryptophan Metabolism. Front Immunol. 2021;12(June):1–14.
6. Jenkins TA, Nguyen JCD, Polglaze KE, Bertrand PP. Influence of tryptophan and serotonin on mood and cognition with a possible role of the gut-brain axis. Nutrients. 2016;8(1):1–15.
7. Cervenka I, Agudelo LZ, Ruas JL. Kynurenines: Tryptophan’s metabolites in exercise, inflammation, and mental health. Science (1979). 2017;357(6349).
8. Gao K, Mu CL, Farzi A, Zhu WY. Tryptophan Metabolism: A Link between the Gut Microbiota and Brain. Advances in Nutrition. 2020;11(3):709–23.
9. Martin KS, Azzolini M, Ruas JL. The kynurenine connection: How exercise shifts muscle tryptophan metabolism and affects energy homeostasis, the immune system, and the brain. Am J Physiol Cell Physiol. 2020;318(5):C818–30.
10. Häfliger P, Charles RP. The l-type amino acid transporter LAT1—an emerging target in cancer. Int J Mol Sci. 2019;20(10):1–14.
11. Zaragozá R. Transport of Amino Acids Across the Blood-Brain Barrier. Front Physiol. 2020;11(September):1–11.
12. Valente-Silva P, Ruas JL. Tryptophan-kynurenine metabolites in exercise and mental health. Research and Perspectives in Endocrine Interactions. 2017;(9783319727899):83–91.
13. Gostner JM, Geisler S, Stonig M, Mair L, Sperner-Unterweger B, Fuchs D. Tryptophan metabolism and related pathways in psychoneuroimmunology: The impact of nutrition and lifestyle. Neuropsychobiology. 2020;79(1):89–99.
14. O’Mahony SM, Clarke G, Borre YE, Dinan TG, Cryan JF. Serotonin, tryptophan metabolism and the brain-gut-microbiome axis. Behavioural Brain Research. 2015;277:32–48.
15. Yamashita M. Potential Role of Neuroactive Tryptophan Metabolites in Central Fatigue: Establishment of the Fatigue Circuit. International Journal of Tryptophan Research. 2020;13.
16. Strasser B, Fuchs D. Diet versus exercise in weight loss and maintenance: Focus on tryptophan. International Journal of Tryptophan Research. 2016;9(1):9–16.
17. Savitz, J. The kynurenine pathway: a finger in every pie. Molecular psychiatry, 25(1), 2020; 131-147.
18. Badawy AAB. Kynurenine pathway of tryptophan metabolism: Regulatory and functional aspects. International Journal of Tryptophan Research. 2017;10(1).
19. Török N, Tanaka M, Vécsei L. Searching for peripheral biomarkers in neurodegenerative diseases: The tryptophan-kynurenine metabolic pathway. Int J Mol Sci. 2020;21(24):1–24.
20. Chen LM, Bao CH, Wu Y, Liang SH, Wang D, Wu LY, et al. Tryptophan-kynurenine metabolism: a link between the gut and brain for depression in inflammatory bowel disease. J Neuroinflammation. 2021;18(1):1–13.
21. Fuertig R, Ceci A, Camus SM, Bezard E, Luippold AH, Hengerer B. LC-MS/MS-based quantification of kynurenine metabolites, tryptophan, monoamines and neopterin in plasma, cerebrospinal fluid and brain. Bioanalysis. 2016;8(18):1903–17.
22. BÓDIS J, SULYOK E, KOPPÁN M, VÁRNAGY Á, PRÉMUSZ V, GÖDÖNY K, et al. Tryptophan Catabolism to Serotonin and Kynurenine in Women Undergoing in-vitro Fertilization. Physiol Res. 2020;69(6):1–12.
23. Strasser B, Geiger D, Schauer M, Gatterer H, Burtscher M, Fuchs D. Effects of exhaustive aerobic exercise on tryptophan-kynurenine metabolism in trained athletes. PLoS One. 2016;11(4):1–10.
24. Ninomiya S, Nakamura N, Nakamura H, Mizutani T, Kaneda Y, Yamaguchi K, et al. Low levels of serum tryptophan underlie skeletal muscle atrophy. Nutrients. 2020;12(4).
25. Metcalfe AJ, Koliamitra C, Javelle F, Bloch W, Zimmer P. Acute and chronic effects of exercise on the kynurenine pathway in humans – A brief review and future perspectives. Physiol Behav [Internet]. 2018;194(July):583–7. Available from: https://doi.org/10.1016/j.physbeh.2018.07.015
26. Klaessens S, Stroobant V, Hoffmann D, Gyrd-Hansen M, Pilotte L, Vigneron N, et al. Tryptophanemia is controlled by a tryptophan-sensing mechanism ubiquitinating tryptophan 2,3-dioxygenase. Proc Natl Acad Sci U S A. 2021;118(23).
27. Taleb S. Tryptophan Dietary Impacts Gut Barrier and Metabolic Diseases. Front Immunol. 2019;10(September):1–7.
28. Saran T, Turska M, Kocki T, Zawadka M, Zieliński G, Turski WA, et al. Effect of 4-week physical exercises on tryptophan, kynurenine and kynurenic acid content in human sweat. Sci Rep [Internet]. 2021;11(1):1–7. Available from: https://doi.org/10.1038/s41598-021-90616-6
29. Sorgdrager FJH, Naudé PJW, Kema IP, Nollen EA, De Deyn PP. Tryptophan metabolism in inflammaging: From biomarker to therapeutic target. Front Immunol. 2019;10(OCT):1–8.
30. Joisten N, Kummerhoff F, Koliamitra C, Schenk A, Walzik D, Hardt L, et al. Exercise and the Kynurenine pathway: Current state of knowledge and results from a randomized cross-over study comparing acute effects of endurance and resistance training. Exerc Immunol Rev. 2020;26(16):24–42.
31. Walker AK, Kavelaars A, Heijnen CJ, Dantzer R. Neuroinflammation and comorbidity of pain and depression. Pharmacol Rev. 2014;66(1):80–101.
32. Wyckelsma VL, Lindkvist W, Venckunas T, Brazaitis M, Kamandulis S, Pääsuke M, et al. Kynurenine aminotransferase isoforms display fiber-type specific expression in young and old human skeletal muscle. Exp Gerontol [Internet]. 2020;134(October 2019):110880. Available from: https://doi.org/10.1016/j.exger.2020.110880
33. Tömösi F, Kecskeméti G, Cseh EK, Szabó E, Rajda C, Kormány R, et al. A validated UHPLC-MS method for tryptophan metabolites: Application in the diagnosis of multiple sclerosis. J Pharm Biomed Anal [Internet]. 2020;185:113246. Available from: https://doi.org/10.1016/j.jpba.2020.113246
34. Zhen D, Liu J, Zhang XD, Song Z. Kynurenic Acid Acts as a Signaling Molecule Regulating Energy Expenditure and Is Closely Associated With Metabolic Diseases. Front Endocrinol (Lausanne). 2022;13(February):1–10.
35. Joisten N, Walzik D, Metcalfe AJ, Bloch W, Zimmer P. Physical Exercise as Kynurenine Pathway Modulator in Chronic Diseases: Implications for Immune and Energy Homeostasis. International Journal of Tryptophan Research. 2020;13.
36. Agus A, Planchais J, Sokol H. Gut Microbiota Regulation of Tryptophan Metabolism in Health and Disease. Cell Host Microbe [Internet]. 2018;23(6):716–24. Available from: https://doi.org/10.1016/j.chom.2018.05.003
37. Wang LS, Zhang M di, Tao X, Zhou YF, Liu XM, Pan R le, et al. LC-MS/MS-based quantification of tryptophan metabolites and neurotransmitters in the serum and brain of mice. J Chromatogr B Analyt Technol Biomed Life Sci [Internet]. 2019;1112(151):24–32. Available from: https://doi.org/10.1016/j.jchromb.2019.02.021
38. Xiao L, Liu Q, Luo M, Xiong L. Gut Microbiota-Derived Metabolites in Irritable Bowel Syndrome. Front Cell Infect Microbiol. 2021;11(September):1–11.
39. Moon JH, Oh CM, Kim H. Serotonin in the regulation of systemic energy metabolism. J Diabetes Investig. 2022;13(10):1639–45.
40. Jones LA, Sun EW, Martin AM, Keating DJ. The ever-changing roles of serotonin. International Journal of Biochemistry and Cell Biology [Internet]. 2020;125(November 2019):105776. Available from: https://doi.org/10.1016/j.biocel.2020.105776
41. Sahu A, Gopalakrishnan L, Gaur N, Chatterjee O, Mol P, Modi PK, et al. The 5-Hydroxytryptamine signaling map: an overview of serotonin-serotonin receptor mediated signaling network. J Cell Commun Signal. 2018;12(4):731–5.
42. Pourhamzeh M, Moravej FG, Arabi M, Shahriari E, Mehrabi S, Ward R, et al. The Roles of Serotonin in Neuropsychiatric Disorders. Cell Mol Neurobiol [Internet]. 2022;42(6):1671–92. Available from: https://doi.org/10.1007/s10571-021-01064-9
43. Moncrieff J, Cooper RE, Stockmann T, Amendola S, Hengartner MP, Horowitz MA. The serotonin theory of depression: a systematic umbrella review of the evidence. 2022;(May):1–14.
44. Jones R, Tarter R, Ross AM. Greenspace interventions, stress and cortisol: A scoping review. Int J Environ Res Public Health. 2021;18(6):1–21.
45. Li C, Cai Q, Su Z, Chen Z, Cao J, Xu F. Could peripheral 5-HT level be used as a biomarker for depression diagnosis and treatment? A narrative minireview. Front Pharmacol. 2023;14(March):1–7.
46. Farzi A, Hassan AM, Zenz G, Holzer P. Diabesity and mood disorders: Multiple links through the microbiota-gut-brain axis. Mol Aspects Med [Internet]. 2019;66(October 2018):80–93. Available from: https://doi.org/10.1016/j.mam.2018.11.003
47. Lefèvre A, Mavel S, Nadal-Desbarats L, Galineau L, Attucci S, Dufour D, et al. Validation of a global quantitative analysis methodology of tryptophan metabolites in mice using LC-MS. Talanta. 2019;195(November 2018):593–8.
48. Valente-Silva P, Cervenka I, Ferreira DMS, Correia JC, Edman S, Horwath O, et al. Effects of tryptophan supplementation and exercise on the fate of kynurenine metabolites in mice and humans. Metabolites. 2021;11(8).
49. Kaur H, Bose C, Mande SS. Tryptophan Metabolism by Gut Microbiome and Gut-Brain-Axis: An in silico Analysis. Front Neurosci. 2019;13(December):1–17.
50. Maguire M, Maguire G. Gut dysbiosis, leaky gut, and intestinal epithelial proliferation in neurological disorders: Towards the development of a new therapeutic using amino acids, prebiotics, probiotics, and postbiotics. Rev Neurosci. 2019;30(2):179–201.
51. Strandwitz, P. Neurotransmitter modulation by the gut microbiota. Brain research, 2018; 1693, 128-133.
52. Chen X, Eslamfam S, Fang L, Qiao S, Ma X. Maintenance of Gastrointestinal Glucose Homeostasis by the Gut-Brain Axis. Curr Protein Pept Sci. 2017;18(6):541–7.
53. Kim N, Yun M, Oh YJ, Choi HJ. Mind-altering with the gut: Modulation of the gut-brain axis with probiotics. Journal of Microbiology. 2018;56(3):172–82.
54. Mittal, R., Debs, L. H., Patel, A. P., Nguyen, D., Patel, K., O’Connor, G., … & Liu, X. Z. Neurotransmitters: The critical modulators regulating gut–brain axis. Journal of cellular physiology, 2017; 232(9), 2359-2372.
55. Sandhu K v., Sherwin E, Schellekens H, Stanton C, Dinan TG, Cryan JF. Feeding the microbiota-gut-brain axis: diet, microbiome, and neuropsychiatry. Translational Research [Internet]. 2017;179(January 2018):223–44. Available from: http://dx.doi.org/10.1016/j.trsl.2016.10.002
56. Gao X, Randell E, Zhou H, Sun G. Higher serum choline and betaine levels are associated with better body composition in male but not female population. PLoS One. 2018;13(2):1–15.
Triptófano y sus metabolitos

Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de Madrid. Investigadora del Centro de Estudios Gregorio Marañón.
El triptófano (TPRF) es un aminoácido esencial (el organismo no puede sintetizarlo) que debe ser incorporado mediante la dieta (1,2), a través de alimentos ricos en proteínas, como la carne, pescado, queso, productos lácteos, huevos, leche, tofu y soja, etc. (3,4). La cantidad recomendada de TRPF para los adultos se sitúa entre los 3,5-6 mg/kg/día, aproximadamente 300 mg de TRPF al día para un adulto (3,5).
En cuanto a sus funciones, el TRPF está implicado en la síntesis de proteínas además de ser el precursor de metabolitos como la quinurenina (QUIN), el ácido quinurénico (AQUIN) y la serotonina (5-HT) (1).
ABSORCIÓN Y TRANSPORTE DEL TRIPTÓFANO
De toda la cantidad de TRPF que entra en el organismo, solamente una parte de este alcanza la circulación portal tras su absorción en el intestino. Según (5), el TRPF logra su mayor concentración en el colon distal, que es donde se lleva a cabo la mayor parte de la degradación proteica. A continuación, se metaboliza en el hígado, para, seguidamente, pasar a la circulación sistémica (3). En este punto, la mayor parte de TRPF se une a la albúmina (aproximadamente un 80-90%) mientras que el resto se queda en forma libre (2). Una dieta pobre en TRPF provocaría la activación de la síntesis de proteínas hepáticas, consumiéndose en primer lugar el TRPF disponible en plasma (6). Los productos de degradación que salen del hígado van a la circulación periférica y después son transportados a otros órganos, como el cerebro, corazón y músculo esquelético. El TRPF que no ha sido metabolizado será utilizado por la microbiota intestinal (7,8)
Para el transporte del triptófano se emplea un sistema de transporte denominado LAT1 (de sus siglas en inglés, L-Amino acid Transporter-1), que también se encarga de conducir otros aminoácidos esenciales (leucina, isoleucina, fenilalanina, metionina, histidina, valina y tirosina) (9–11), por lo que el TRPF compite con estos por la unión al transportador (7,12). LAT1 lleva los aminoácidos esenciales hacia las células a cambio de la salida de sustratos (como la glutamina o los aminoácidos esenciales de cadena ramificados), por lo que también actúa como antiportador (10,13). Dentro de la familia LAT1, destaca un transportador de membrana, SLC7A5, que es independiente del pH y del sodio y se expresa en células que necesitan de un aporte continuo de aminoácidos, como las células neurales, gliales, placentarias o células endoteliales de la barrera hematoencefálica (BHE) (10). Gracias a que LAT1 se sitúa en las células neuronales, el TRPF es capaz de atravesar la BHE (14) sin ningún problema, aunque debe competir con el resto de aminoácidos neutros, como por ejemplo los aminoácidos de cadena ramificada (de sus siglas en inglés, BCAAs), que serán expuestos en otro apartado. Si existe una disminución en la concentración de BCAAs plasmáticas, la cantidad de TRPF libre que entra en el cerebro será mayor (Yamashita, 2020).
Según la evidencia científica, la ingesta en una comida de hidratos de carbono (HC) junto a una fuente proteica (que contenga TRPF) provoca que la insulina se accione y dirija al resto de aminoácidos que no son el TRPF al tejido muscular, permaneciendo este en circulación sanguínea (2). De esta manera, la concentración de aminoácidos que se encontraban en circulación y podían competir con el TRPF por su unión a la albumina disminuye provocando que la disponibilidad del TRPF aumente e ingrese más rápido en el cerebro (Gostner et al., 2020; Strasser & Fuchs, 2016).
METABOLISMO DEL TRIPTÓFANO
El metabolismo detallado del TRPF tiene lugar a través de tres vías.
1.Vía de la quinurenina
La vía de la quinurenina (QUIN) se encarga de la degradación de aproximadamente el 95% de TRPF en el hígado (17). Está controlada por las enzimaslimitantes de la velocidad indoleamina 2,3-dioxigenasa (IDO) y Trp 2,3-dioxigenasa (TDO) y finaliza con la producción de nicotinamina adenina dinucleótido (NAD) (Figura 1) (1,3,15,18–25). Estas dos enzimas se encargan de catabolizar el paso de TRPF a QUIN pero difieren en ciertos aspectos.
Por un lado, la TDO es una enzima tetramérica específica del hígado (aunque presenta una mínima expresión en el cerebro (18) que se encarga de degradar el TRPF que procede de la dieta (26). Una vez que el TRPF es absorbido en las células del intestino, llega al hígado donde se metaboliza por la TDO. La cantidad de TRPF que no es catabolizado por esta enzima difunde a la circulación sanguínea con el objetivo de estar disponible para los tejidos periféricos (27). Se ha visto que los glucocorticoides inducen la expresión de la TDO (2).
Por otro lado, la IDO es una enzima monomérica que se expresa en cerebro, tracto gastrointestinal (TGI) y riñones (órganos inmunitarios e inflamatorios) e interviene en la regulación de la inmunidad (2,18,26). Existen dos isoformas de la IDO; la IDO 1 que se expresa en casi todas las células extrahepáticas y la IDO 2, de descubrimiento reciente, por lo que aún se desconoce su papel, aunque se sabe que metaboliza el TRPF con una actividad enzimática menor a la de la IDO 1 (28). A este respecto, siempre que hablemos de IDO, nos referiremos a la IDO 1. Las citocinas proinflamatorias (interferón-gamma (IFN-γ), el factor de necrosis tumoral alfa (TNF-α), el receptor tipo Toll 4 (TLR4) y el receptor de interleuquina 1β (IL-1R) son los principales inductores de esta enzima (2,17,24,29), mientras que el óxido nítrico es un inhibidor (28). Además, se ha visto que los ácidos grasos de cadena corta (AGCC) que surgen de la microbiota, concretamente el butirato, alteran la expresión de la IDO, dando como resultado una reducción de la producción de QUIN (2). Como consecuencia, la actividad de la IDO se ha relacionado con la inflamación, por lo que es normal medir la relación QUIN/TRPF en enfermedades en las que existe un proceso inflamatorio de fondo, como las enfermedades cardiovasculares, el cáncer, la obesidad… (1,3,29). Por ello, en condiciones inflamatorias, la IDO presenta una actividad mayor a la TDO y la vía de la QUIN se encuentra altamente activada metabolizando TRPF, lo que conduce a una disponibilidad disminuida del aminoácido de manera constante y a una menor síntesis de 5-HT (30). En cambio, en condiciones normales, es la TDO la enzima protagonista y la encargada de catabolizar el primer paso de la degradación del TRPF en el hígado (3).
Finalmente, conocemos que la TDO presenta una reducida actividad enzimática en el músculo esquelético, de lo que se deduce que la mayor parte de QUIN se producirá en el hígado por medio de esta enzima, o en las células inmunitarias (por parte de la IDO) y luego se transporta a la fibra muscular (9). Sin embargo, según el estudio de (26), la TDO sufre una degradación en el hígado, mientras que la IDO continúa con su actividad enzimática normal, por lo que los niveles de QUIN que se observan en plasma proceden de esta ruta enzimática. En este aspecto, conviene remarcar la importancia de proponer la relación QUIN/TRPF con la finalidad de conocer la actividad de la IDO, ya que parece ser la más influyente en esta conversión enzimática. Además, también se ha visto que un nivel elevado de TRPF en sangre contribuye a una estabilización de la conformación de la TDO, estando el aminoácido disponible para ser degradado por la vía de la QUIN, mientras que los niveles bajos de TRPF desencadenan la poliubiquitinacion de la TDO, impidiendo el catabolismo del TRPF. Así pues, sería recomendable que la concentración plasmática de TRPF fuera constante, pero esto resulta complicado teniendo en cuenta que este aminoácido es suministrado a través de la dieta.
Como hemos señalado anteriormente, la TDO y la IDO dan lugar a la formación de QUIN, que a su vez sigue metabolizándose en otros productos, como el AQUIN (AQUIN) (por acción de la QUIN aminotransferasa, QUINAT) (31). La QUINAT cuenta con 4 isoformas en hígado, cerebro y músculo esquelético (QUINAT I, II, III y IV) (32). El AQUIN es un compuesto neuroprotector antagonista del receptor de N-metil D-aspartato (NMDA) (17,33,34) cuyas cantidades producidas son mínimas (10 µmol/día) ya que, en su mayoría, la vía de la QUIN se dirige hacia la síntesis de ácido quinolínico y NAD+ (34,35). El AQUIN está implicado en procesos fisiológicos y patológicos de trastornos funcionales cerebrales y gastrointestinales. Además, parece desempeñar funciones antioxidantes, ya que es capaz de eliminar las especies reactivas de oxígeno (ROS) y reducir la inflamación (19). No obstante, según señalan (19), los niveles bajos de AQUIN pueden promover el daño tisular y el incremento de las células inflamatorias en enfermedades neurodegenerativas, por lo que habría que tener en consideración los niveles de triptófano como precursor del AQUIN en el cerebro, ya que a diferencia del TRPF y la QUIN, el AQUIN no puede atravesar la BHE debido a su condición impermeable (8,19,36).
2.Vía de la hidroxilación
La vía minoritaria por la que se metaboliza el TRPF (alrededor del 1-2%), se denomina vía de la hidroxilación, en la que se sintetiza el neurotransmisor serotonina (5-hidroxitriptamina, 5-HT) (3,31,37). Esta reacción es catalizada por la enzima triptófano hidroxilasa (TpH) y existe en dos isoformas; la TpH1 que se expresa en las células enterocromafines (CE) del epitelio intestinal y la TpH2 que se produce en las neuronas serotoninérgicas del SNC y Sistema Nervioso Entérico (SNE) (2,6,38,39). Por ello, la síntesis de 5-HT tiene lugar a nivel cerebral o a nivel periférico. No obstante, la mayoría de 5-HT (más del 90%) (40) es sintetizada en las CE del intestino y a partir de ahí es captada por las plaquetas y entra en la circulación sistémica (39). Por tanto, la serotonina periférica no alcanza el Sistema Nervioso Central (SNC) porque no puede atravesar la BHE (39,41,42). Además, es rápidamente metabolizada al ácido 5-hidroxiindolacético (43). Por otro lado, el transportador de recaptación selectiva de 5-HT (SERT; codificado por el gen SLC6A4) de las células epiteliales intestinales se encarga de eliminar la 5-HT del espacio intersticial una vez que ha sido producida por las CE (36), si bien esa recaptación de 5-HT parece ser muy poco efectiva, por lo que las plaquetas que se encuentran circulando por la lámina propia captan la 5-HT que resulta de este proceso almacenándola y transportándola a tejidos periféricos. Además, estas plaquetas son capaces de promover la expresión de receptores de 5-HT que favorezcan la agregación plaquetaria (44), mientras que el tromboxano A2 o el adenosin difosfato (ADP) contribuyen a que la 5-HT active las plaquetas (2). En conclusión, la síntesis cerebral de 5-HT depende de la disponibilidad que exista de su precursor, el TRPF, y, a su vez, de la competencia de éste con otros aminoácidos por la unión al transportador LAT1 (1).
En este sentido, persiste la duda de si el nivel plasmático de 5-HT correlaciona con el nivel sináptico. Debido a la gran dificultad existente en medir directamente el nivel de 5-HT de la hendidura sináptica, aun no se ha podido establecer dicha asociación, por lo que los investigadores llevan a cabo estudios sobre el nivel de 5-HT en aquellos fluidos biológicos más accesibles, como el plasma, suero o incluso plaquetas (45). Además, es importante tener en cuenta la influencia de la microbiota en los niveles (intestinal y circulante) de 5-HT, ya que distintos metabolitos microbianos pueden ejercer un efecto modulador sobre la síntesis de 5-HT en las CE. De hecho, la 5-HT es considerada un neurotransmisor, capaz de transmitir señales desde el intestino a las neuronas del sistema nervioso, actuando como una hormona que conecta el eje intestino-cerebro (6,36,40).
Por otra parte, la 5-HT sintetizada en el intestino es liberada en respuesta a la contracción del TGI (40) entrando en el torrente circulatorio para ejercer sus acciones, como la regulación del tono vascular, la hemostasia primaria o la motilidad intestinal. De hecho, la 5-HT periférica desempeña un rol clave como una hormona capaz de modular el metabolismo periférico. En respuesta al ayuno, la serotonina se eleva como resultado de la regulación al alza de la expresión de la TpH1, promoviendo la lipólisis de los adipocitos y aportando sustratos para la gluconeogénesis del hígado (40). En cambio, la 5-HT que alcanza el SNC, se encarga del control del estado de ánimo, de la ingesta de alimentos, la ansiedad o el sueño (3).
3.Vía de los indoles. Producción de triptófano y sus metabolitos por la microbiota
Además de las dos vías comentadas por las que el TRPF puede ser degradado, existe una tercera ruta protagonizada por los microorganismos del intestino (vía de los indoles). Constituye el 5% del metabolismo del TRPF (2,27,46). Algunas bacterias que pertenecen a la microbiota intestinal son capaces de transformar el TRPF en triptamina y metabolitos indoles gracias a que expresan enzimas responsables de la degradación del TRPF, como la triptofanasa y la descarboxilasa. Los indoles presentan funciones en la homeostasis metabólica y en la estimulación del sistema inmunitario, además de que algunos de estos, como la triptamina, ayudan a mantener la integridad de la barrera intestinal gracias a la activación del receptor arilo de hidrocarburos (de sus siglas en inglés AhR, Aryl hydrocarbon Receptor) (3,4,27). El AhR es un factor de transcripción (al que se le unen ciertos ligandos) que regula la expresión génica de ciertas enzimas, además de encargarse de las señales ambientales, tóxicas, dietéticas e influir en la inmunidad y diferenciación celular (8,19,47,48). Al AhR se le unen ligandos, como la QUIN o el AQUIN que estimulan su expresión (17) y reducen la inflamación, permitiendo que el sistema inmune detecte de manera temprana las células malignas que podrían dar lugar a la aparición de algún tipo de cáncer (48)
La microbiota intestinal que se encuentra en el intestino grueso y es capaz de degradar el TRPF, determina, por tanto, la cantidad de este aminoácido que pasará a circulación portal, además de limitar la disponibilidad del mismo para el huésped (49). Por consiguiente, también los niveles de 5-HT cerebrales se verán afectados (8,49,50)
Es importante señalar que cualquier alteración en la relación huésped-microbiota podría iniciar el desarrollo de ciertas patologías. Por ejemplo, un desajuste en la relación QUIN/indoles se relaciona con la afectación en enfermedades como la obesidad y la enfermedad celíaca (3)
En definitiva, la microbiota intestinal interactúa con el sistema nervioso central y el sistema nervioso entérico (también denominado sistema nervioso intrínseco) a través del eje bidireccional intestino-cerebro. Esto quiere decir que el intestino contribuye a la función y comportamiento del cerebro y que este mismo, modula ciertos aspectos del TGI, como la movilidad, la secreción o la absorción (6,51–55)
Desde otro punto de vista, la microbiota también es capaz de producir 5-HT aunque aún no están dilucidados los mecanismos por los que ésta se sintetiza. Se han sugerido dos posibilidades: en primer lugar, los ácidos grasos de cadena corta (AGCC) pueden indicar la producción de 5-HT a las CE estimulando la expresión de TpH1 y, en segundo lugar, la microbiota es capaz de emplear el TRPF luminal para la síntesis de 5-HT (14,36,51,56). De hecho, aproximadamente el 20% del microbioma intestinal posee enzimas capaces de sintetizar 5-HT, como la Candida, Streptococcus, Escherichia y Enterococcus (8,14).

Figura 1. Metabolismo del triptófano, del que se derivan la vía de la quinurenina y la vía de producción de serotonina. TpH1, triptófano hidroxilasa 1; TpH2, triptófano hidroxilasa 2; SNC, Sistema Nervioso Central; SNE, Sistema Nervioso Entérico; CE, células enterocromafines; IDO, Indoleamina 2,3-dioxigenasa; TDO, triptófano 2,3-dioxigenasa; QUINAT, quinurenina aminotransferasa. Adaptado a partir de los trabajos de (8) y (27). Creado con BioRender.
BIBLIOGRAFÍA:
1. Kałużna-Czaplińska J, Gątarek P, Chirumbolo S, Chartrand MS, Bjørklund G. How important is tryptophan in human health? Crit Rev Food Sci Nutr. 2019;59(1):72–88.
2. Roth W, Zadeh K, Vekariya R, Ge Y, Mohamadzadeh M. Tryptophan metabolism and gut-brain homeostasis. Int J Mol Sci. 2021;22(6):1–23.
3. Melhem NJ, Taleb S. Tryptophan: From diet to cardiovascular diseases. Int J Mol Sci. 2021;22(18).
4. Roager HM, Licht TR. Microbial tryptophan catabolites in health and disease. Nat Commun [Internet]. 2018;9(1):1–10. Available from: http://dx.doi.org/10.1038/s41467-018-05470-4
5. Grifka-Walk HM, Jenkins BR, Kominsky DJ. Amino Acid Trp: The Far Out Impacts of Host and Commensal Tryptophan Metabolism. Front Immunol. 2021;12(June):1–14.
6. Jenkins TA, Nguyen JCD, Polglaze KE, Bertrand PP. Influence of tryptophan and serotonin on mood and cognition with a possible role of the gut-brain axis. Nutrients. 2016;8(1):1–15.
7. Cervenka I, Agudelo LZ, Ruas JL. Kynurenines: Tryptophan’s metabolites in exercise, inflammation, and mental health. Science (1979). 2017;357(6349).
8. Gao K, Mu CL, Farzi A, Zhu WY. Tryptophan Metabolism: A Link between the Gut Microbiota and Brain. Advances in Nutrition. 2020;11(3):709–23.
9. Martin KS, Azzolini M, Ruas JL. The kynurenine connection: How exercise shifts muscle tryptophan metabolism and affects energy homeostasis, the immune system, and the brain. Am J Physiol Cell Physiol. 2020;318(5):C818–30.
10. Häfliger P, Charles RP. The l-type amino acid transporter LAT1—an emerging target in cancer. Int J Mol Sci. 2019;20(10):1–14.
11. Zaragozá R. Transport of Amino Acids Across the Blood-Brain Barrier. Front Physiol. 2020;11(September):1–11.
12. Valente-Silva P, Ruas JL. Tryptophan-kynurenine metabolites in exercise and mental health. Research and Perspectives in Endocrine Interactions. 2017;(9783319727899):83–91.
13. Gostner JM, Geisler S, Stonig M, Mair L, Sperner-Unterweger B, Fuchs D. Tryptophan metabolism and related pathways in psychoneuroimmunology: The impact of nutrition and lifestyle. Neuropsychobiology. 2020;79(1):89–99.
14. O’Mahony SM, Clarke G, Borre YE, Dinan TG, Cryan JF. Serotonin, tryptophan metabolism and the brain-gut-microbiome axis. Behavioural Brain Research. 2015;277:32–48.
15. Yamashita M. Potential Role of Neuroactive Tryptophan Metabolites in Central Fatigue: Establishment of the Fatigue Circuit. International Journal of Tryptophan Research. 2020;13.
16. Strasser B, Fuchs D. Diet versus exercise in weight loss and maintenance: Focus on tryptophan. International Journal of Tryptophan Research. 2016;9(1):9–16.
17. Savitz, J. The kynurenine pathway: a finger in every pie. Molecular psychiatry, 25(1), 2020; 131-147.
18. Badawy AAB. Kynurenine pathway of tryptophan metabolism: Regulatory and functional aspects. International Journal of Tryptophan Research. 2017;10(1).
19. Török N, Tanaka M, Vécsei L. Searching for peripheral biomarkers in neurodegenerative diseases: The tryptophan-kynurenine metabolic pathway. Int J Mol Sci. 2020;21(24):1–24.
20. Chen LM, Bao CH, Wu Y, Liang SH, Wang D, Wu LY, et al. Tryptophan-kynurenine metabolism: a link between the gut and brain for depression in inflammatory bowel disease. J Neuroinflammation. 2021;18(1):1–13.
21. Fuertig R, Ceci A, Camus SM, Bezard E, Luippold AH, Hengerer B. LC-MS/MS-based quantification of kynurenine metabolites, tryptophan, monoamines and neopterin in plasma, cerebrospinal fluid and brain. Bioanalysis. 2016;8(18):1903–17.
22. BÓDIS J, SULYOK E, KOPPÁN M, VÁRNAGY Á, PRÉMUSZ V, GÖDÖNY K, et al. Tryptophan Catabolism to Serotonin and Kynurenine in Women Undergoing in-vitro Fertilization. Physiol Res. 2020;69(6):1–12.
23. Strasser B, Geiger D, Schauer M, Gatterer H, Burtscher M, Fuchs D. Effects of exhaustive aerobic exercise on tryptophan-kynurenine metabolism in trained athletes. PLoS One. 2016;11(4):1–10.
24. Ninomiya S, Nakamura N, Nakamura H, Mizutani T, Kaneda Y, Yamaguchi K, et al. Low levels of serum tryptophan underlie skeletal muscle atrophy. Nutrients. 2020;12(4).
25. Metcalfe AJ, Koliamitra C, Javelle F, Bloch W, Zimmer P. Acute and chronic effects of exercise on the kynurenine pathway in humans – A brief review and future perspectives. Physiol Behav [Internet]. 2018;194(July):583–7. Available from: https://doi.org/10.1016/j.physbeh.2018.07.015
26. Klaessens S, Stroobant V, Hoffmann D, Gyrd-Hansen M, Pilotte L, Vigneron N, et al. Tryptophanemia is controlled by a tryptophan-sensing mechanism ubiquitinating tryptophan 2,3-dioxygenase. Proc Natl Acad Sci U S A. 2021;118(23).
27. Taleb S. Tryptophan Dietary Impacts Gut Barrier and Metabolic Diseases. Front Immunol. 2019;10(September):1–7.
28. Saran T, Turska M, Kocki T, Zawadka M, Zieliński G, Turski WA, et al. Effect of 4-week physical exercises on tryptophan, kynurenine and kynurenic acid content in human sweat. Sci Rep [Internet]. 2021;11(1):1–7. Available from: https://doi.org/10.1038/s41598-021-90616-6
29. Sorgdrager FJH, Naudé PJW, Kema IP, Nollen EA, De Deyn PP. Tryptophan metabolism in inflammaging: From biomarker to therapeutic target. Front Immunol. 2019;10(OCT):1–8.
30. Joisten N, Kummerhoff F, Koliamitra C, Schenk A, Walzik D, Hardt L, et al. Exercise and the Kynurenine pathway: Current state of knowledge and results from a randomized cross-over study comparing acute effects of endurance and resistance training. Exerc Immunol Rev. 2020;26(16):24–42.
31. Walker AK, Kavelaars A, Heijnen CJ, Dantzer R. Neuroinflammation and comorbidity of pain and depression. Pharmacol Rev. 2014;66(1):80–101.
32. Wyckelsma VL, Lindkvist W, Venckunas T, Brazaitis M, Kamandulis S, Pääsuke M, et al. Kynurenine aminotransferase isoforms display fiber-type specific expression in young and old human skeletal muscle. Exp Gerontol [Internet]. 2020;134(October 2019):110880. Available from: https://doi.org/10.1016/j.exger.2020.110880
33. Tömösi F, Kecskeméti G, Cseh EK, Szabó E, Rajda C, Kormány R, et al. A validated UHPLC-MS method for tryptophan metabolites: Application in the diagnosis of multiple sclerosis. J Pharm Biomed Anal [Internet]. 2020;185:113246. Available from: https://doi.org/10.1016/j.jpba.2020.113246
34. Zhen D, Liu J, Zhang XD, Song Z. Kynurenic Acid Acts as a Signaling Molecule Regulating Energy Expenditure and Is Closely Associated With Metabolic Diseases. Front Endocrinol (Lausanne). 2022;13(February):1–10.
35. Joisten N, Walzik D, Metcalfe AJ, Bloch W, Zimmer P. Physical Exercise as Kynurenine Pathway Modulator in Chronic Diseases: Implications for Immune and Energy Homeostasis. International Journal of Tryptophan Research. 2020;13.
36. Agus A, Planchais J, Sokol H. Gut Microbiota Regulation of Tryptophan Metabolism in Health and Disease. Cell Host Microbe [Internet]. 2018;23(6):716–24. Available from: https://doi.org/10.1016/j.chom.2018.05.003
37. Wang LS, Zhang M di, Tao X, Zhou YF, Liu XM, Pan R le, et al. LC-MS/MS-based quantification of tryptophan metabolites and neurotransmitters in the serum and brain of mice. J Chromatogr B Analyt Technol Biomed Life Sci [Internet]. 2019;1112(151):24–32. Available from: https://doi.org/10.1016/j.jchromb.2019.02.021
38. Xiao L, Liu Q, Luo M, Xiong L. Gut Microbiota-Derived Metabolites in Irritable Bowel Syndrome. Front Cell Infect Microbiol. 2021;11(September):1–11.
39. Moon JH, Oh CM, Kim H. Serotonin in the regulation of systemic energy metabolism. J Diabetes Investig. 2022;13(10):1639–45.
40. Jones LA, Sun EW, Martin AM, Keating DJ. The ever-changing roles of serotonin. International Journal of Biochemistry and Cell Biology [Internet]. 2020;125(November 2019):105776. Available from: https://doi.org/10.1016/j.biocel.2020.105776
41. Sahu A, Gopalakrishnan L, Gaur N, Chatterjee O, Mol P, Modi PK, et al. The 5-Hydroxytryptamine signaling map: an overview of serotonin-serotonin receptor mediated signaling network. J Cell Commun Signal. 2018;12(4):731–5.
42. Pourhamzeh M, Moravej FG, Arabi M, Shahriari E, Mehrabi S, Ward R, et al. The Roles of Serotonin in Neuropsychiatric Disorders. Cell Mol Neurobiol [Internet]. 2022;42(6):1671–92. Available from: https://doi.org/10.1007/s10571-021-01064-9
43. Moncrieff J, Cooper RE, Stockmann T, Amendola S, Hengartner MP, Horowitz MA. The serotonin theory of depression: a systematic umbrella review of the evidence. 2022;(May):1–14.
44. Jones R, Tarter R, Ross AM. Greenspace interventions, stress and cortisol: A scoping review. Int J Environ Res Public Health. 2021;18(6):1–21.
45. Li C, Cai Q, Su Z, Chen Z, Cao J, Xu F. Could peripheral 5-HT level be used as a biomarker for depression diagnosis and treatment? A narrative minireview. Front Pharmacol. 2023;14(March):1–7.
46. Farzi A, Hassan AM, Zenz G, Holzer P. Diabesity and mood disorders: Multiple links through the microbiota-gut-brain axis. Mol Aspects Med [Internet]. 2019;66(October 2018):80–93. Available from: https://doi.org/10.1016/j.mam.2018.11.003
47. Lefèvre A, Mavel S, Nadal-Desbarats L, Galineau L, Attucci S, Dufour D, et al. Validation of a global quantitative analysis methodology of tryptophan metabolites in mice using LC-MS. Talanta. 2019;195(November 2018):593–8.
48. Valente-Silva P, Cervenka I, Ferreira DMS, Correia JC, Edman S, Horwath O, et al. Effects of tryptophan supplementation and exercise on the fate of kynurenine metabolites in mice and humans. Metabolites. 2021;11(8).
49. Kaur H, Bose C, Mande SS. Tryptophan Metabolism by Gut Microbiome and Gut-Brain-Axis: An in silico Analysis. Front Neurosci. 2019;13(December):1–17.
50. Maguire M, Maguire G. Gut dysbiosis, leaky gut, and intestinal epithelial proliferation in neurological disorders: Towards the development of a new therapeutic using amino acids, prebiotics, probiotics, and postbiotics. Rev Neurosci. 2019;30(2):179–201.
51. Strandwitz, P. Neurotransmitter modulation by the gut microbiota. Brain research, 2018; 1693, 128-133.
52. Chen X, Eslamfam S, Fang L, Qiao S, Ma X. Maintenance of Gastrointestinal Glucose Homeostasis by the Gut-Brain Axis. Curr Protein Pept Sci. 2017;18(6):541–7.
53. Kim N, Yun M, Oh YJ, Choi HJ. Mind-altering with the gut: Modulation of the gut-brain axis with probiotics. Journal of Microbiology. 2018;56(3):172–82.
54. Mittal, R., Debs, L. H., Patel, A. P., Nguyen, D., Patel, K., O’Connor, G., … & Liu, X. Z. Neurotransmitters: The critical modulators regulating gut–brain axis. Journal of cellular physiology, 2017; 232(9), 2359-2372.
55. Sandhu K v., Sherwin E, Schellekens H, Stanton C, Dinan TG, Cryan JF. Feeding the microbiota-gut-brain axis: diet, microbiome, and neuropsychiatry. Translational Research [Internet]. 2017;179(January 2018):223–44. Available from: http://dx.doi.org/10.1016/j.trsl.2016.10.002
56. Gao X, Randell E, Zhou H, Sun G. Higher serum choline and betaine levels are associated with better body composition in male but not female population. PLoS One. 2018;13(2):1–15.
Otras Noticias

Encuentros con expertos: La sanidad española mirando al futuro
“La Sanidad española mirando al futuro”, un ciclo de encuentros con expertos que muestra casos…

BCAAs y sus aplicaciones clínicas
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

Glutamina: Metabolismo, ejercicio físico y suplementación
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

La colina como biomarcador
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de…
Noticias relacionadas

Encuentros con expertos: La sanidad española mirando al futuro
“La Sanidad española mirando al futuro”, un ciclo de encuentros con expertos que muestra casos…

BCAAs y sus aplicaciones clínicas
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

Glutamina: Metabolismo, ejercicio físico y suplementación
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

La colina como biomarcador
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de…




