La colina como biomarcador

Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de Madrid. Investigadora del Centro de Estudios Gregorio Marañón.
La colina es un nutriente esencial (reconocido por el Instituto de Medicina en 1998 (1) cuyo mayor aporte al organismo procede de la dieta. Existe una pequeña producción de colina a nivel endógeno, concretamente en el hígado, y también en otros tejidos del cuerpo, incluyendo el cerebro (2) a través de la vía de la fosfatidiletanolamina N-transferasa hepática (PEMT, de sus siglas en inglés). Esta enzima emplea el grupo metilo de la S-adenosilmetionina (SAM) para formar una nueva fracción de colina (3,4). No obstante, la síntesis de colina en el cerebro aún no está bien esclarecida. Por un lado, conocemos que existen actividades enzimáticas de la colina acetiltransferasa y PEMT en los terminales neuronales, pero, por otro lado, parece ser que el cerebro obtiene la colina a partir de tres fuentes (2):
- La colina libre que se almacena en las membranas de las neuronas como fosfatidilcolina (PC), ya que es capaz de atravesar la barrera hematoencefálica (BHE).
- La colina que surge tras la degradación de la acetilcolina[1] por la enzima acetilcolina esterasa.
- La hidrolisis de la PC debido a la actividad especifica de las fosfolipasas.
Respecto a las recomendaciones de ingesta de colina dictadas por la Autoridad Europea de Seguridad Alimentaria (EFSA, de sus siglas en inglés), se ha establecido una ingesta adecuada (IA) ligeramente inferior de 400 mg de colina al día para todos los adultos, aunque en algunos estudios existen diferencias entre sexos (550 mg/día para hombres y 425 mg/día para mujeres), pero los datos apuntan que estos niveles no son alcanzados por la población, situándose aun en los 370 mg/día (1,5).
La colina en la dieta es aportada de dos maneras que difieren en su solubilidad:
- En forma liposoluble (PC o esfingomielina). La PC es la principal forma de consumir colina. En su metabolismo, las formas liposolubles son empaquetadas en quilomicrones, se absorben y se transportan a la circulación linfática (3,5)
- En forma hidrosoluble (colina libre, fosfocolina o glicerofosfocolina). A diferencia de las formas liposolubles, estas entran en circulación portal siendo absorbidas por el hígado (Zeisel, 2006).
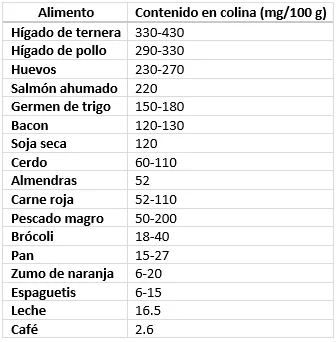
Entre los alimentos fuente de colina podemos citar los huevos, la carne de vacuno, el pollo, la leche y el pescado, así como algunos alimentos vegetales, entre los que destacan las verduras crucíferas y algunas judías. Por lo general, los alimentos de origen animal suelen contener más cantidades de colina que aquellos de origen vegetal (las frutas contienen <10 mg de colina por 100 g, y la mayoría de las verduras contienen <50 mg de colina por 100) (Tabla 1) (4–6).
Tabla 1. Contenido de colina de algunos alimentos. (Adaptado de Glade y cols., 2019; Wiedeman y cols., 2018)
ABSORCIÓN, METABOLISMO Y DEGRADACIÓN DE LA COLINA
La absorción y el metabolismo de la colina en el intestino dependen en gran parte de su estructura química y de la microbiota intestinal (1) En términos generales, el metabolismo de la colina comprende cuatro vías: la síntesis de betaína, fosfolípidos, trimetilamina (TMA) y acetilcolina (Figura 1).
1.Vía de la betaína y dimetilglicina
Comúnmente, la colina es ingerida en forma de lecitina, concretamente como PC, seguidamente se hidroliza por la fosfolipasa D y se libera la colina quedando disponible para ser absorbida de forma rápida en el intestino delgado. Seguidamente, se transporta al hígado donde puede ser convertida en sus metabolitos; betaina y dimetilglicina (Figura 1) (1,7,8). Por ello, la colina como nutriente esencial constituye un biomarcador seguro y reproducible del estado de la colina en plasma, ya que las concentraciones plasmáticas son proporcionales a la ingesta dietética de este nutriente, alcanzando su pico máximo a las 2 horas después de su ingesta manteniéndose durante las 6-10 horas siguientes (4).
La betaína es un donante de grupos metilo, por lo que participa en la conversión de la homocisteína a metionina llevada a cabo por la betaína-homocisteína S-metiltransferasa (BHMT)(9). Sin embargo, existe otra manera de convertir homocisteína en metionina, esta es empleando el metil tetrahidrofolato como donante de grupos metilo. Generalmente, la metionina es el precursor del donante universal de metilo, la SAM, una sustancia implicada la síntesis de PC. Por otro lado, la dimetilglicina sirve como fuente para la glicina además de aportar grupos metilo en las reacciones bioquímicas (1,3,5,8).
2.Vía de la fosfatidilcolina (fosfolípidos)
Como se muestra en la Figura 1, la colina también puede ser convertida en PC por medio de la colina quinasa en las células no cerebrales. Cuando la colina se encuentra dentro de la célula, se combina con el diacilglicerol para formar la PC (10).
Existe una relación entre el metabolismo de la colina, la metionina y el folato en tanto que interaccionan exactamente en el punto en el que la homocisteína es convertida en metionina. La deficiencia de colina se correlaciona con concentraciones elevadas de homocisteína plasmática y, estas, a su vez, con mayor riesgo cardiovascular. Por tanto, lo interesante desde el punto de vista bioquímico es que suceda la metilación de homocisteína a metionina con el objetivo de reducir las concentraciones de homocisteína (3–5).
3.Vía de la TMA
Las cantidades elevadas de colina que no logran ser absorbidas previamente en el intestino delgado, alcanzan el intestino grueso donde se metabolizan en metilaminas gracias a los microorganismos presentes (7). Debido a que la colina se encuentra en el organismo como un ion de amonio cuaternario se derivan dos funciones importantes:
- La colina contiene una fracción de trimetilamonio y por ello puede actuar como precursor de la trimetilamina (TMA), la cual se transforma en N-óxido de trimetilamina (TMAO) por acción de la enzima hepática monooxigenasa que contiene flavina (5). Parece ser que existen concentraciones elevadas de TMAO en eventos cardiovasculares, aunque no está clara la relación (1,7).
- La colina es soluble en agua, por lo que necesita un transportador que sea capaz de atravesar la membrana celular. A este respecto, existen tres transportadores de colina con sus respectivas diferencias. (11)
- El transportador de colina de alta afinidad 1 (CHT1) se expresa en las neuronas colinérgicas, se relaciona con la síntesis de acetilcolina y tiene gran afinidad por la colina.
- Los transportadores catiónicos orgánicos OCT1 y OCT2 tienen baja afinidad por la colina y se encuentran en el hígado y el riñón.
- El último transportador son las proteínas similares al transportador de colina (CTL1-5) que están distribuidas de manera ubicua.
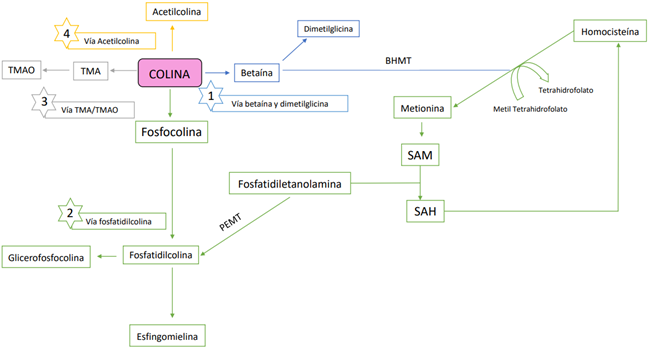
Figura 1. Metabolismo de la colina. TMA,Trimetilamina; TMAO, N-óxido de trimetilamina; PEMT, fosfatidiletanolamina N-metiltransferasa; SAM, S-adenosil metionina; SAH, S-adenosil homocisteína; BHMT, betaína-homocisteína S-metiltransferasa.(Adaptado de Zeisel y cols., 2006; Wiedeman y cols., 2018; Bekdash y cols., 2019).
4.Vía de la acetilcolina
La colina acetiltransferasa (ChAT) es la encargada de acetilar una pequeña parte de la colina dietética, además de influir sobre la disponibilidad de colina y acetil-CoA (Figura 2). A este respecto, la tasa de síntesis de la acetilcolina está determinada por la disponibilidad de colina y Acetil-CoA, a priori, ya que en el cerebro no suelen existir saturaciones de la CAT. Si la síntesis de la acetilcolina cerebral fuera mayor, la liberación del neurotransmisor también sería mayor. De esta manera, en los momentos en los que no sea necesario el aporte de acetilcolina, la colina que es recogida por el cerebro puede entrar en una reserva de almacenamiento (por ejemplo, la PC de las membranas) antes de ser convertida en acetilcolina, lo que es de importante relevancia para neuronas que presentan una mayor demanda de colina, manteniendo así la liberación de acetilcolina (3). Asimismo, los niveles bajos de colina conducen también a una reducción en la síntesis de acetilcolina, por ser la colina uno de los precursores en la formación de la acetilcolina (2,3,12).
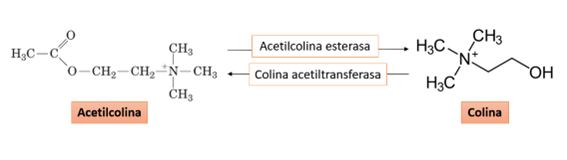
Figura 2. Conversión de acetilcolina a colina, y viceversa (Adaptado de Nelson y cols., 2013)
FUNCIONES DE LA COLINA
Entre sus funciones biológicas, la colina participa como precursor en la síntesis de fosfolípidos, como la PC (el lípido de membrana más abundante en las células humanas) y la esfingomielina; como una fuente de grupos metilo y; en la síntesis de la acetilcolina regulando la neurotransmisión en diversas regiones del cerebro (2–5,7,8,11,13,14). Se conoce que el cerebro y el sistema nervioso necesitan colina para numerosas funciones entre las que se encuentran el control muscular, la regulación del estado de ánimo y la memoria, y la formación de las membranas celulares del organismo (7,13).
NIVELES PLASMÁTICOS DE COLINA
Por lo que concierne a las concentraciones séricas de colina en individuos sanos, sabemos que existen diferencias según el estadio de la vida. Concretamente, durante el embarazo, se ha constatado que las concentraciones plasmáticas de colina de las mujeres son, aproximadamente, un 45% mayores que las de mujeres no embarazadas, demostrando que la demanda de colina es elevada y, aunque existe mayor capacidad de sintetizar colina, las reservas de este nutriente terminan agotándose (3). De hecho, los recién nacidos presentan tres veces más niveles de colina que sus madres (8).
De manera general, los rangos de concentraciones plasmáticas de colina en sujetos sanos se sitúan entre los 800 y los 8000 ng/ml (1,14,15). Para ser un poco más exactos, Glade y cols., (2022) (4) señalan concentraciones plasmáticas en ayunas de adultos que se encuentran entre los 728-2.080 ng/ml, mientras que Penry y cols., (2008) y Gao y cols., (2018) [(16) y (9)] apuntan a concentraciones plasmáticas de colina que rondan los 1000-1560 ng/ml.
POSIBLES APLICACIONES CLÍNICAS DE LA COLINA
Las patologías con mayor número de estudios para las que la colina podría ser un potencial biomarcador se describen a continuación.
Enfermedades cardiovasculares (ECV):
Existen bastantes estudios contradictorios a la hora de relacionar la ingesta de colina y las enfermedades cardiovasculares (ECV) (8,13,14,17). En principio, parece que, consumir cantidades suficientes de colina en la dieta en adultos ≥65 años podría ayudar a mantener niveles adecuados de presión arterial (17). Por otro lado, se ha propuesto a la colina como un indicador de riesgo de ECV debido a su relación en el metabolismo del TMAO. La colina que no es absorbida en el intestino delgado llega al intestino grueso donde es metabolizada en TMA por la microbiota intestinal, como se ha señalado anteriormente. Después de la absorción, la TMA se transforma en TMAO (5). Concentraciones elevadas de TMAO se han observado en eventos cardiovasculares, pero no existe aún suficiente evidencia para corroborar esta relación (18). Sin embargo, diversos estudios establecen una relación directa y positiva entre mayor ingesta de colina dietética y mayor riesgo de padecer ECV (6), todo lo contrario, a lo que señalan Taesuwan y cols., (2019) (17) en su artículo, siendo esta relación inversa. Finalmente, como entre las funciones de la colina se encuentra la de participar como fuente de grupos metilo, en pacientes de avanzada edad esta capacidad se ha visto reducida, dando lugar a una elevación de la homocisteína, marcador de riesgo cardiovascular (3,5)
Alzheimer:
Los bajos niveles de ingesta de colina se han relacionado con fatiga y disfunción muscular pudiendo dañar la función cerebral y la memoria. A largo plazo, la falta de colina puede aumentar el riesgo de trastornos neurológicos, como la enfermedad de Alzheimer (1,2). En el cerebro de los adultos mayores, la colina extracelular es escasa, por lo que la colina que deriva de la PC podría ser especialmente importante. Esta puede ser transportada a las neuronas formando parte de la apolipoproteína ApoE gracias a su capacidad de atravesar la BHE. De hecho, en la enfermedad de Alzheimer se han observado niveles anormales de fosfolípidos (2,3,6,8,13). Esta alteración en los niveles se piensa que puede deberse tanto a una ingesta disminuida de colina como a una variación en el transporte de esta a través de la BHE. Por ello, se aconseja la ingesta de colina en pacientes de avanzada edad (3,4)
Esteatosis hepática o enfermedad del hígado graso no alcohólico:
La síntesis de fosfolípidos en el hígado se correlaciona de forma positiva con la ingesta de colina en la dieta. Sin embargo, cuando la disponibilidad de este nutriente es reducida, se inhibe la síntesis de la PC hepática y no se exportan a circulación lipoproteínas de muy baja densidad (VLDL, de sus siglas en inglés) ricas en triglicéridos. En consecuencia, se acumulan dentro de los hepatocitos. Por tanto, la deficiencia de colina en la dieta provoca el aumento de lípidos en el hígado desencadenando la esteatosis hepática o la enfermedad del hígado graso no alcohólico.
De manera contraria, proporcionar colina a los hepatocitos se ha relacionado con un aumento en la incorporación de PC a las VLDL y la exportación de estas a la circulación, con los respectivos triglicéridos (3,4). Igualmente, la deficiencia de colina en humanos se asocia con daños hepáticos, aspecto que se demuestra por la elevación de las aminotransferasas séricas y con la presencia daños a nivel muscular. Este último mecanismo parece ser debido a una menor fragilidad de las membranas musculares (2,3,5)
La principal vía terapéutica que se propone para estos casos son los suplementos de colina, pero se necesitan más estudios que evalúen una administración dietética bien planteada (6,8,13)
CONCLUSIÓN
La colina representa un nutriente esencial cuyo aporte proviene de la alimentación. Por ello, la dieta debe ser adecuada y completa en términos de calidad y cantidad. Además, sería interesante realizar un seguimiento de los niveles plasmáticos de colina a fin de detectar posibles deficiencias, y emplear los suplementos cuando sea necesario para revertir la situación. Sin embargo, hacen falta más estudios de intervención (ensayos clínicos) que evalúen el efecto y la seguridad de dichos suplementos.
BIBLIOGRAFÍA:
1. Mödinger Y, Schön C, Wilhelm M, Hals PA. Plasma kinetics of choline and choline metabolites after a single dose of SuperbaBoostTM krill oil or choline bitartrate in healthy volunteers. Nutrients. 2019;11(10):1–15.
2. Bekdash RA. Neuroprotective effects of choline and other methyl donors. Nutrients. 2019;11(12).
3. Zeisel SH. Requirements in Adults. 2006;(26):229–50.
4. Glade MJ, Crook MA. Choline deficiency: Is it being recognized? Nutrition. 2022;94:2021–3.
5. Wiedeman AM, Barr SI, Green TJ, Xu Z, Innis SM, Kitts DD. Dietary choline intake: Current state of knowledge across the life cycle. Nutrients. 2018;10(10).
6. van Parys A, Karlsson T, Vinknes KJ, Olsen T, Øyen J, Dierkes J, et al. Food Sources Contributing to Intake of Choline and Individual Choline Forms in a Norwegian Cohort of Patients With Stable Angina Pectoris. Front Nutr. 2021;8(May):4–11.
7. Fennema D, Phillips IR, Shephard EA. Trimethylamine and trimethylamine N-oxide, a Flavin-Containing Monooxygenase 3 (FMO3)-mediated host-microbiome metabolic axis implicated in health and disease. Drug Metabolism and Disposition. 2016;44(11):1839–50.
8. Smolders L, de Wit NJW, Balvers MGJ, Obeid R, Vissers MMM, Esser D. Natural Choline from Egg Yolk Phospholipids Is More E ffi ciently Absorbed Compared with Choline Healthy Adults. Nutrients. 2019;11(2758):1–13.
9. Gao X, Randell E, Zhou H, Sun G. Higher serum choline and betaine levels are associated with better body composition in male but not female population. PLoS One. 2018;13(2):1–15.
10. Snider SA, Margison KD, Ghorbani P, LeBlond ND, O’Dwyer C, Nunes JRC, et al. Choline transport links macrophage phospholipid metabolism and inflammation. Journal of Biological Chemistry [Internet]. 2018;293(29):11600–11. Available from: http://dx.doi.org/10.1074/jbc.RA118.003180
11. Hirai K, Watanabe S, Nishijima N, Shibata K, Hase A, Yamanaka T, et al. Molecular and functional analysis of choline transporters and antitumor effects of choline transporter-like protein 1 inhibitors in human pancreatic cancer cells. Int J Mol Sci. 2020;21(15):1–17.
12. Foster-Brown C, Harrison K, Kelaiditis C, Pilic L, Mavrommatis Y. Associations between dietary-choline intake, B-vitamins and anxiety levels. Proceedings of the Nutrition Society. 2021;80(OCE1):2021.
13. National Institutes of Health. Datos sobre la Colina. Office of Dietary Supplements [Internet]. 2019;1–3. Available from: https://ods.od.nih.gov/pdf/factsheets/Choline-DatosEnEspanol.pdf
14. Song M, Xu BP, Liang Q, Wei Y, Song Y, Chen P, et al. Association of serum choline levels and all-cause mortality risk in adults with hypertension: a nested case–control study. Nutr Metab (Lond) [Internet]. 2021;18(1):1–10. Available from: https://doi.org/10.1186/s12986-021-00637-1
15. Miao M, Du J, Che B, Guo Y, Zhang J, Ju Z, et al. Circulating choline pathway nutrients and depression after ischemic stroke. Eur J Neurol. 2022;29(2):459–68.
16. Penry JT, Manore MM. Choline: An important micronutrient for maximal endurance-exercise performance? Int J Sport Nutr Exerc Metab. 2008;18(2):191–203.
17. Taesuwan S, Vermeylen F, Caudill MA, Cassano PA. Relation of choline intake with blood pressure in the National Health and Nutrition Examination Survey 2007-2010. American Journal of Clinical Nutrition. 2019;109(3):648–55.
18. Wilcox J, Skye SM, Graham B, Zabell A, Li XS, Li L, et al. Dietary Choline Supplements, but Not Eggs, Raise Fasting TMAO Levels in Participants with Normal Renal Function: A Randomized Clinical Trial. American Journal of Medicine [Internet]. 2021;134(9):1160-1169.e3. Available from: https://doi.org/10.1016/j.amjmed.2021.03.016
[1] La acetilcolina es el neurotransmisor por excelencia del sistema nervioso central (SNC) y del sistema nervioso periférico (SNP) (nervios motores somáticos y partes del sistema nervioso autónomo), cuya estructura molecular se compone de un éster de ácido acético y colina. No obstante, también encontramos cantidades de acetilcolina exógenas en distintas familias de plantas, como por ejemplo las Leguminosae, Solanaceae y Gramineae.
La colina como biomarcador

Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de Madrid. Investigadora del Centro de Estudios Gregorio Marañón.
La colina es un nutriente esencial (reconocido por el Instituto de Medicina en 1998 (1) cuyo mayor aporte al organismo procede de la dieta. Existe una pequeña producción de colina a nivel endógeno, concretamente en el hígado, y también en otros tejidos del cuerpo, incluyendo el cerebro (2) a través de la vía de la fosfatidiletanolamina N-transferasa hepática (PEMT, de sus siglas en inglés). Esta enzima emplea el grupo metilo de la S-adenosilmetionina (SAM) para formar una nueva fracción de colina (3,4). No obstante, la síntesis de colina en el cerebro aún no está bien esclarecida. Por un lado, conocemos que existen actividades enzimáticas de la colina acetiltransferasa y PEMT en los terminales neuronales, pero, por otro lado, parece ser que el cerebro obtiene la colina a partir de tres fuentes (2):
- La colina libre que se almacena en las membranas de las neuronas como fosfatidilcolina (PC), ya que es capaz de atravesar la barrera hematoencefálica (BHE).
- La colina que surge tras la degradación de la acetilcolina[1] por la enzima acetilcolina esterasa.
- La hidrolisis de la PC debido a la actividad especifica de las fosfolipasas.
Respecto a las recomendaciones de ingesta de colina dictadas por la Autoridad Europea de Seguridad Alimentaria (EFSA, de sus siglas en inglés), se ha establecido una ingesta adecuada (IA) ligeramente inferior de 400 mg de colina al día para todos los adultos, aunque en algunos estudios existen diferencias entre sexos (550 mg/día para hombres y 425 mg/día para mujeres), pero los datos apuntan que estos niveles no son alcanzados por la población, situándose aun en los 370 mg/día (1,5).
La colina en la dieta es aportada de dos maneras que difieren en su solubilidad:
- En forma liposoluble (PC o esfingomielina). La PC es la principal forma de consumir colina. En su metabolismo, las formas liposolubles son empaquetadas en quilomicrones, se absorben y se transportan a la circulación linfática (3,5)
- En forma hidrosoluble (colina libre, fosfocolina o glicerofosfocolina). A diferencia de las formas liposolubles, estas entran en circulación portal siendo absorbidas por el hígado (Zeisel, 2006).
Entre los alimentos fuente de colina podemos citar los huevos, la carne de vacuno, el pollo, la leche y el pescado, así como algunos alimentos vegetales, entre los que destacan las verduras crucíferas y algunas judías. Por lo general, los alimentos de origen animal suelen contener más cantidades de colina que aquellos de origen vegetal (las frutas contienen <10 mg de colina por 100 g, y la mayoría de las verduras contienen <50 mg de colina por 100) (Tabla 1) (4–6).
Tabla 1. Contenido de colina de algunos alimentos. (Adaptado de Glade y cols., 2019; Wiedeman y cols., 2018)

ABSORCIÓN, METABOLISMO Y DEGRADACIÓN DE LA COLINA
La absorción y el metabolismo de la colina en el intestino dependen en gran parte de su estructura química y de la microbiota intestinal (1) En términos generales, el metabolismo de la colina comprende cuatro vías: la síntesis de betaína, fosfolípidos, trimetilamina (TMA) y acetilcolina (Figura 1).
1.Vía de la betaína y dimetilglicina
Comúnmente, la colina es ingerida en forma de lecitina, concretamente como PC, seguidamente se hidroliza por la fosfolipasa D y se libera la colina quedando disponible para ser absorbida de forma rápida en el intestino delgado. Seguidamente, se transporta al hígado donde puede ser convertida en sus metabolitos; betaina y dimetilglicina (Figura 1) (1,7,8). Por ello, la colina como nutriente esencial constituye un biomarcador seguro y reproducible del estado de la colina en plasma, ya que las concentraciones plasmáticas son proporcionales a la ingesta dietética de este nutriente, alcanzando su pico máximo a las 2 horas después de su ingesta manteniéndose durante las 6-10 horas siguientes (4).
La betaína es un donante de grupos metilo, por lo que participa en la conversión de la homocisteína a metionina llevada a cabo por la betaína-homocisteína S-metiltransferasa (BHMT)(9). Sin embargo, existe otra manera de convertir homocisteína en metionina, esta es empleando el metil tetrahidrofolato como donante de grupos metilo. Generalmente, la metionina es el precursor del donante universal de metilo, la SAM, una sustancia implicada la síntesis de PC. Por otro lado, la dimetilglicina sirve como fuente para la glicina además de aportar grupos metilo en las reacciones bioquímicas (1,3,5,8).
2.Vía de la fosfatidilcolina (fosfolípidos)
Como se muestra en la Figura 1, la colina también puede ser convertida en PC por medio de la colina quinasa en las células no cerebrales. Cuando la colina se encuentra dentro de la célula, se combina con el diacilglicerol para formar la PC (10).
Existe una relación entre el metabolismo de la colina, la metionina y el folato en tanto que interaccionan exactamente en el punto en el que la homocisteína es convertida en metionina. La deficiencia de colina se correlaciona con concentraciones elevadas de homocisteína plasmática y, estas, a su vez, con mayor riesgo cardiovascular. Por tanto, lo interesante desde el punto de vista bioquímico es que suceda la metilación de homocisteína a metionina con el objetivo de reducir las concentraciones de homocisteína (3–5).
3.Vía de la TMA
Las cantidades elevadas de colina que no logran ser absorbidas previamente en el intestino delgado, alcanzan el intestino grueso donde se metabolizan en metilaminas gracias a los microorganismos presentes (7). Debido a que la colina se encuentra en el organismo como un ion de amonio cuaternario se derivan dos funciones importantes:
- La colina contiene una fracción de trimetilamonio y por ello puede actuar como precursor de la trimetilamina (TMA), la cual se transforma en N-óxido de trimetilamina (TMAO) por acción de la enzima hepática monooxigenasa que contiene flavina (5). Parece ser que existen concentraciones elevadas de TMAO en eventos cardiovasculares, aunque no está clara la relación (1,7).
- La colina es soluble en agua, por lo que necesita un transportador que sea capaz de atravesar la membrana celular. A este respecto, existen tres transportadores de colina con sus respectivas diferencias. (11)
- El transportador de colina de alta afinidad 1 (CHT1) se expresa en las neuronas colinérgicas, se relaciona con la síntesis de acetilcolina y tiene gran afinidad por la colina.
- Los transportadores catiónicos orgánicos OCT1 y OCT2 tienen baja afinidad por la colina y se encuentran en el hígado y el riñón.
- El último transportador son las proteínas similares al transportador de colina (CTL1-5) que están distribuidas de manera ubicua.

Figura 1. Metabolismo de la colina. TMA,Trimetilamina; TMAO, N-óxido de trimetilamina; PEMT, fosfatidiletanolamina N-metiltransferasa; SAM, S-adenosil metionina; SAH, S-adenosil homocisteína; BHMT, betaína-homocisteína S-metiltransferasa.(Adaptado de Zeisel y cols., 2006; Wiedeman y cols., 2018; Bekdash y cols., 2019).
4.Vía de la acetilcolina
La colina acetiltransferasa (ChAT) es la encargada de acetilar una pequeña parte de la colina dietética, además de influir sobre la disponibilidad de colina y acetil-CoA (Figura 2). A este respecto, la tasa de síntesis de la acetilcolina está determinada por la disponibilidad de colina y Acetil-CoA, a priori, ya que en el cerebro no suelen existir saturaciones de la CAT. Si la síntesis de la acetilcolina cerebral fuera mayor, la liberación del neurotransmisor también sería mayor. De esta manera, en los momentos en los que no sea necesario el aporte de acetilcolina, la colina que es recogida por el cerebro puede entrar en una reserva de almacenamiento (por ejemplo, la PC de las membranas) antes de ser convertida en acetilcolina, lo que es de importante relevancia para neuronas que presentan una mayor demanda de colina, manteniendo así la liberación de acetilcolina (3). Asimismo, los niveles bajos de colina conducen también a una reducción en la síntesis de acetilcolina, por ser la colina uno de los precursores en la formación de la acetilcolina (2,3,12).

Figura 2. Conversión de acetilcolina a colina, y viceversa (Adaptado de Nelson y cols., 2013)
FUNCIONES DE LA COLINA
Entre sus funciones biológicas, la colina participa como precursor en la síntesis de fosfolípidos, como la PC (el lípido de membrana más abundante en las células humanas) y la esfingomielina; como una fuente de grupos metilo y; en la síntesis de la acetilcolina regulando la neurotransmisión en diversas regiones del cerebro (2–5,7,8,11,13,14). Se conoce que el cerebro y el sistema nervioso necesitan colina para numerosas funciones entre las que se encuentran el control muscular, la regulación del estado de ánimo y la memoria, y la formación de las membranas celulares del organismo (7,13).
NIVELES PLASMÁTICOS DE COLINA
Por lo que concierne a las concentraciones séricas de colina en individuos sanos, sabemos que existen diferencias según el estadio de la vida. Concretamente, durante el embarazo, se ha constatado que las concentraciones plasmáticas de colina de las mujeres son, aproximadamente, un 45% mayores que las de mujeres no embarazadas, demostrando que la demanda de colina es elevada y, aunque existe mayor capacidad de sintetizar colina, las reservas de este nutriente terminan agotándose (3). De hecho, los recién nacidos presentan tres veces más niveles de colina que sus madres (8).
De manera general, los rangos de concentraciones plasmáticas de colina en sujetos sanos se sitúan entre los 800 y los 8000 ng/ml (1,14,15). Para ser un poco más exactos, Glade y cols., (2022) (4) señalan concentraciones plasmáticas en ayunas de adultos que se encuentran entre los 728-2.080 ng/ml, mientras que Penry y cols., (2008) y Gao y cols., (2018) [(16) y (9)] apuntan a concentraciones plasmáticas de colina que rondan los 1000-1560 ng/ml.
POSIBLES APLICACIONES CLÍNICAS DE LA COLINA
Las patologías con mayor número de estudios para las que la colina podría ser un potencial biomarcador se describen a continuación.
Enfermedades cardiovasculares (ECV):
Existen bastantes estudios contradictorios a la hora de relacionar la ingesta de colina y las enfermedades cardiovasculares (ECV) (8,13,14,17). En principio, parece que, consumir cantidades suficientes de colina en la dieta en adultos ≥65 años podría ayudar a mantener niveles adecuados de presión arterial (17). Por otro lado, se ha propuesto a la colina como un indicador de riesgo de ECV debido a su relación en el metabolismo del TMAO. La colina que no es absorbida en el intestino delgado llega al intestino grueso donde es metabolizada en TMA por la microbiota intestinal, como se ha señalado anteriormente. Después de la absorción, la TMA se transforma en TMAO (5). Concentraciones elevadas de TMAO se han observado en eventos cardiovasculares, pero no existe aún suficiente evidencia para corroborar esta relación (18). Sin embargo, diversos estudios establecen una relación directa y positiva entre mayor ingesta de colina dietética y mayor riesgo de padecer ECV (6), todo lo contrario, a lo que señalan Taesuwan y cols., (2019) (17) en su artículo, siendo esta relación inversa. Finalmente, como entre las funciones de la colina se encuentra la de participar como fuente de grupos metilo, en pacientes de avanzada edad esta capacidad se ha visto reducida, dando lugar a una elevación de la homocisteína, marcador de riesgo cardiovascular (3,5)
Alzheimer:
Los bajos niveles de ingesta de colina se han relacionado con fatiga y disfunción muscular pudiendo dañar la función cerebral y la memoria. A largo plazo, la falta de colina puede aumentar el riesgo de trastornos neurológicos, como la enfermedad de Alzheimer (1,2). En el cerebro de los adultos mayores, la colina extracelular es escasa, por lo que la colina que deriva de la PC podría ser especialmente importante. Esta puede ser transportada a las neuronas formando parte de la apolipoproteína ApoE gracias a su capacidad de atravesar la BHE. De hecho, en la enfermedad de Alzheimer se han observado niveles anormales de fosfolípidos (2,3,6,8,13). Esta alteración en los niveles se piensa que puede deberse tanto a una ingesta disminuida de colina como a una variación en el transporte de esta a través de la BHE. Por ello, se aconseja la ingesta de colina en pacientes de avanzada edad (3,4)
Esteatosis hepática o enfermedad del hígado graso no alcohólico:
La síntesis de fosfolípidos en el hígado se correlaciona de forma positiva con la ingesta de colina en la dieta. Sin embargo, cuando la disponibilidad de este nutriente es reducida, se inhibe la síntesis de la PC hepática y no se exportan a circulación lipoproteínas de muy baja densidad (VLDL, de sus siglas en inglés) ricas en triglicéridos. En consecuencia, se acumulan dentro de los hepatocitos. Por tanto, la deficiencia de colina en la dieta provoca el aumento de lípidos en el hígado desencadenando la esteatosis hepática o la enfermedad del hígado graso no alcohólico.
De manera contraria, proporcionar colina a los hepatocitos se ha relacionado con un aumento en la incorporación de PC a las VLDL y la exportación de estas a la circulación, con los respectivos triglicéridos (3,4). Igualmente, la deficiencia de colina en humanos se asocia con daños hepáticos, aspecto que se demuestra por la elevación de las aminotransferasas séricas y con la presencia daños a nivel muscular. Este último mecanismo parece ser debido a una menor fragilidad de las membranas musculares (2,3,5)
La principal vía terapéutica que se propone para estos casos son los suplementos de colina, pero se necesitan más estudios que evalúen una administración dietética bien planteada (6,8,13)
CONCLUSIÓN
La colina representa un nutriente esencial cuyo aporte proviene de la alimentación. Por ello, la dieta debe ser adecuada y completa en términos de calidad y cantidad. Además, sería interesante realizar un seguimiento de los niveles plasmáticos de colina a fin de detectar posibles deficiencias, y emplear los suplementos cuando sea necesario para revertir la situación. Sin embargo, hacen falta más estudios de intervención (ensayos clínicos) que evalúen el efecto y la seguridad de dichos suplementos.
BIBLIOGRAFÍA:
1. Mödinger Y, Schön C, Wilhelm M, Hals PA. Plasma kinetics of choline and choline metabolites after a single dose of SuperbaBoostTM krill oil or choline bitartrate in healthy volunteers. Nutrients. 2019;11(10):1–15.
2. Bekdash RA. Neuroprotective effects of choline and other methyl donors. Nutrients. 2019;11(12).
3. Zeisel SH. Requirements in Adults. 2006;(26):229–50.
4. Glade MJ, Crook MA. Choline deficiency: Is it being recognized? Nutrition. 2022;94:2021–3.
5. Wiedeman AM, Barr SI, Green TJ, Xu Z, Innis SM, Kitts DD. Dietary choline intake: Current state of knowledge across the life cycle. Nutrients. 2018;10(10).
6. van Parys A, Karlsson T, Vinknes KJ, Olsen T, Øyen J, Dierkes J, et al. Food Sources Contributing to Intake of Choline and Individual Choline Forms in a Norwegian Cohort of Patients With Stable Angina Pectoris. Front Nutr. 2021;8(May):4–11.
7. Fennema D, Phillips IR, Shephard EA. Trimethylamine and trimethylamine N-oxide, a Flavin-Containing Monooxygenase 3 (FMO3)-mediated host-microbiome metabolic axis implicated in health and disease. Drug Metabolism and Disposition. 2016;44(11):1839–50.
8. Smolders L, de Wit NJW, Balvers MGJ, Obeid R, Vissers MMM, Esser D. Natural Choline from Egg Yolk Phospholipids Is More E ffi ciently Absorbed Compared with Choline Healthy Adults. Nutrients. 2019;11(2758):1–13.
9. Gao X, Randell E, Zhou H, Sun G. Higher serum choline and betaine levels are associated with better body composition in male but not female population. PLoS One. 2018;13(2):1–15.
10. Snider SA, Margison KD, Ghorbani P, LeBlond ND, O’Dwyer C, Nunes JRC, et al. Choline transport links macrophage phospholipid metabolism and inflammation. Journal of Biological Chemistry [Internet]. 2018;293(29):11600–11. Available from: http://dx.doi.org/10.1074/jbc.RA118.003180
11. Hirai K, Watanabe S, Nishijima N, Shibata K, Hase A, Yamanaka T, et al. Molecular and functional analysis of choline transporters and antitumor effects of choline transporter-like protein 1 inhibitors in human pancreatic cancer cells. Int J Mol Sci. 2020;21(15):1–17.
12. Foster-Brown C, Harrison K, Kelaiditis C, Pilic L, Mavrommatis Y. Associations between dietary-choline intake, B-vitamins and anxiety levels. Proceedings of the Nutrition Society. 2021;80(OCE1):2021.
13. National Institutes of Health. Datos sobre la Colina. Office of Dietary Supplements [Internet]. 2019;1–3. Available from: https://ods.od.nih.gov/pdf/factsheets/Choline-DatosEnEspanol.pdf
14. Song M, Xu BP, Liang Q, Wei Y, Song Y, Chen P, et al. Association of serum choline levels and all-cause mortality risk in adults with hypertension: a nested case–control study. Nutr Metab (Lond) [Internet]. 2021;18(1):1–10. Available from: https://doi.org/10.1186/s12986-021-00637-1
15. Miao M, Du J, Che B, Guo Y, Zhang J, Ju Z, et al. Circulating choline pathway nutrients and depression after ischemic stroke. Eur J Neurol. 2022;29(2):459–68.
16. Penry JT, Manore MM. Choline: An important micronutrient for maximal endurance-exercise performance? Int J Sport Nutr Exerc Metab. 2008;18(2):191–203.
17. Taesuwan S, Vermeylen F, Caudill MA, Cassano PA. Relation of choline intake with blood pressure in the National Health and Nutrition Examination Survey 2007-2010. American Journal of Clinical Nutrition. 2019;109(3):648–55.
18. Wilcox J, Skye SM, Graham B, Zabell A, Li XS, Li L, et al. Dietary Choline Supplements, but Not Eggs, Raise Fasting TMAO Levels in Participants with Normal Renal Function: A Randomized Clinical Trial. American Journal of Medicine [Internet]. 2021;134(9):1160-1169.e3. Available from: https://doi.org/10.1016/j.amjmed.2021.03.016
[1] La acetilcolina es el neurotransmisor por excelencia del sistema nervioso central (SNC) y del sistema nervioso periférico (SNP) (nervios motores somáticos y partes del sistema nervioso autónomo), cuya estructura molecular se compone de un éster de ácido acético y colina. No obstante, también encontramos cantidades de acetilcolina exógenas en distintas familias de plantas, como por ejemplo las Leguminosae, Solanaceae y Gramineae.
Otras Noticias

Encuentros con expertos: La sanidad española mirando al futuro
“La Sanidad española mirando al futuro”, un ciclo de encuentros con expertos que muestra casos…

Triptófano y sus metabolitos
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense…

BCAAs y sus aplicaciones clínicas
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

Glutamina: Metabolismo, ejercicio físico y suplementación
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…
Noticias relacionadas

Encuentros con expertos: La sanidad española mirando al futuro
“La Sanidad española mirando al futuro”, un ciclo de encuentros con expertos que muestra casos…

Triptófano y sus metabolitos
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense…

BCAAs y sus aplicaciones clínicas
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

Glutamina: Metabolismo, ejercicio físico y suplementación
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…




