Glutamina: Metabolismo, ejercicio físico y suplementación

Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de Madrid. Investigadora del Centro de Estudios Gregorio Marañón.
La glutamina es el aminoácido más abundante en el organismo (hasta el 40% de la reserva de aminoácidos libres en el músculo cardíaco) (1–3) y representa del 5 al 6% de los aminoácidos que se incorporan a las proteínas (aminoácidos proteinogénicos). Estructuralmente, está constituida por dos grupos aminos (grupo α-amino y grupo amida), por lo que resulta fundamental en el transporte de nitrógeno (3). De hecho, la proporción de glutamina que se encuentra libre en plasma constituye una de las principales fuentes de carbono y nitrógeno y, por lo general, se mantiene en concentraciones elevadas para proporcionar estos átomos imprescindibles en la biosíntesis (1).
Existen controversias al clasificar a la glutamina como aminoácido no esencial o condicionalmente esencial, ya que, aunque el cuerpo sea capaz de sintetizar glutamina, en condiciones de estrés (por ej., sepsis, infecciones, ejercicio intenso…) en los que la demanda del organismo se encuentra aumentada, la glutamina debe de obtenerse de fuentes exógenas (carne, pescado, lácteos, legumbres y nueces)[1] (2–4), aunque también puede requerirse un suplemento de glutamina con el fin de mantener las concentraciones plasmáticas en rangos fisiológicos (6).
METABOLISMO
El equilibrio entre la síntesis, liberación y captación de glutamina por parte de los órganos y tejidos determinan la concentración y disponibilidad de este aminoácido (5). Sabemos que ciertos órganos y tejidos humanos presentan una actividad de síntesis de glutamina específica, es el caso del hígado, músculo esquelético, tejido adiposo, cerebro y pulmones (3). Por tanto, las concentraciones de glutamina tisulares y en circulación sistémica dependen de la expresión o actividad de las enzimas implicadas en la producción (glutamina sintetasa, GS) (Figura 1) e hidrólisis (glutaminasa, GLS) de la misma (Figura 2). Dentro de la célula, la GS se encuentra en el citosol ya que produce glutamina para la síntesis de proteínas y nucleótidos citoplasmáticos, mientras que la GLS se sitúa en la mitocondria, principalmente, ya que cataliza la conversión de glutamina en glutamato para que este después entre en el ciclo de Krebs (3). En concreto, el glutamato junto al amoníaco (NH3) y ATP forman la glutamina, que después es liberada y transportada al plasma.
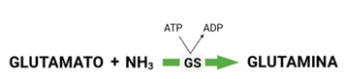
Figura 1. Síntesis de glutamina por la glutamina sintetasa (GS).
La GLS cataliza la reacción inversa, la hidrólisis de glutamina en glutamato produciendo amonio (NH4) (1–3). Por tanto, indirectamente, la producción de glutamina es dependiente de la disponibilidad de glutamato[2] (3).
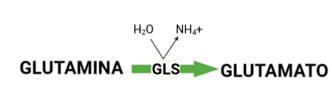
Figura 2. Hidrólisis de la glutamina por la glutaminasa (GLS).
A este respecto, resulta importante distinguir los organismos y tejidos humanos encargados de sintetizar y degradar glutamina en estado fisiológico y patológico (3):
- Cerebro y riñones: no presentan GS, por lo que son dependientes de la disponibilidad de glutamina plasmática tanto en condiciones fisiológicas como patológicas.
- Pulmones y tejido adiposo: presentan GS y GLS, por lo que son capaces de sintetizar y degradar glutamina en ambas condiciones.
- Intestino: es el órgano de mayor consumo de glutamina (7). Sin embargo, cuando existe una patología, se incrementa el consumo de glutamina en comparación con los estados libres de enfermedad.
- Las células del sistema inmune son altamente dependientes de glucosa y glutamina en estado fisiológico, pero incluso más en estados patológicos.
- El hígado y el músculo esquelético son los almacenes de glutamina por excelencia. En condiciones fisiológicas, tanto el hígado como el músculo esquelético pueden sintetizar glutamina ya que presentan GS, pero en estados catabólicos (ingesta reducida de HC y/o aminoácidos, estrés…) el hígado consume glutamina (gracias a que posee GLS) y el músculo esquelético es capaz de sintetizar glutamina (porque exhibe GS).
HOMEOSTASIS DE LA GLUTAMINA EN DISTINTOS ÓRGANOS
INTESTINO:
La glutamina es necesaria para el mantenimiento de la barrera intestinal y el funcionamiento adecuado del revestimiento del tracto gastrointestinal. Puede ayudar a mantener la integridad del intestino y mejorar la absorción de nutrientes. De hecho, en este órgano resulta cuantitativamente más notable que la glucosa en cuanto a sustrato energético. Particularmente, los enterocitos metabolizan el carbono de la glutamina mediante dos vías principales (3):
- Formación de δ-1-pirrolina-5-carboxilato, que conlleva la síntesis de prolina, ornitina y citrulina a partir del carbono de la glutamina. Para este proceso se emplea aproximadamente el 10% de la concentración de aminoácidos que se encuentra en el intestino.
- Mediante la conversión en α-cetoglutarato (intermediario en el ciclo de Krebs).
Aunque un 10-15% de la glutamina se incorpora a la proteína que forma parte de los tejidos, la mayor proporción (se estima que un 75%) es metabolizada en el ciclo de Krebs para producir ATP (3). Por tanto, en el intestino, la concentración de glutamina es baja, debido a la alta actividad de la GLS y a la elevada afinidad de la enzima por su sustrato (3).
Las células intestinales se encuentran unidas a la membrana de la mitocondria, y en estas se halla la GLS, de modo que, en este tejido es de especial interés mantener una correcta modulación de la actividad de este enzima para prevenir la traslocación bacteriana así como promover una adecuada absorción de nutrientes. A este respecto, se encuentran descritos en la literatura científica reciente como la actividad de la GLS es menor, es el caso del ayuno prolongado o los estados de malnutrición, mientras que tras la administración de BCAAs, L-alanil-L-glutamina o en el periodo posprandial, la actividad de la enzima está aumentada (3).
MÚSCULO ESQUELÉTICO:
Como se ha señalado, el músculo esquelético, junto al hígado, son los mayores reservorios de glutamina. Por su parte, el músculo esquelético está implicado en la síntesis, almacenamiento y liberación de glutamina. No obstante, la actividad de la GS es baja. En consecuencia, el tejido muscular tiene una gran influencia en la disponibilidad de la glutamina en el organismo. Se estima que el 80% de la glutamina se encuentra en el tejido muscular esquelético (30 veces más que en el plasma) y que el contenido de glutamina dentro del músculo comprende entre el 50-60% de la reserva total de aminoácidos libres del tejido muscular esquelético (3,8).
En el musculo esquelético, existen dos tipos de fibras en las que se encuentran diferencias en cuanto a la concentración de glutamina; las fibras tipo 1 (fibras oxidativas) y fibras tipo 2 (fibras glucolíticas). Las primeras son las que mayor concentración presentan (hasta tres veces más) debido a que cuentan con más GS y, mayor disponibilidad de ATP, a diferencia de las fibras tipo 2. De esto, deducimos que la concentración de glutamina varía según el tipo de fibras musculares (2,3,5). Por último, añadir que el músculo esquelético es capaz de liberar glutamina a la circulación sistémica a razón de 7.300.000 ng/ml por hora (8).
Factores que estimulan la liberación de glutamina en el músculo esquelético:
Los glucocorticoides impulsan la liberación de glutamina al espacio extracelular, en tanto que las hormonas (insulina y los factores de crecimiento similares a la insulina (IGF)) estimulan el transporte de glutamina al medio intracelular. Existen unos canales dependientes de sodio que transportan la glutamina al interior de las células (con consumo de ATP). Dicho transporte es más rápido que el transporte del resto de aminoácidos. No obstante, mantener una disponibilidad de glutamina constante en el contenido intracelular y un correcto funcionamiento del gradiente transmembrana resulta un reto, debido a la cantidad de factores que intervienen, como la competencia de otros aminoácidos por unirse a los transportadores o la misma afinidad de la glutamina por su unión al transportador (3).
En el musculo esquelético y en estados post-absortivos, se consigue sintetizar aproximadamente el 50% de glutamina gracias a la captación de glutamato, que mediante la GS se convierte en glutamina. No obstante, otras maneras de sintetizar glutamina consisten en el catabolismo de proteínas musculares y en la liberación de aminoácidos cuyos esqueletos de carbono se emplean para formar glutamina “de novo” (como aminoácidos esenciales de cadena ramificada, aspartato, asparagina y glutamato) (3).
En este punto, cabe mencionar el ciclo alanina-glutamina que tiene lugar en el músculo esquelético:
En el estado de post-absorción, la glutamina libera nitrógeno al músculo esquelético (debido a que contiene dos átomos de nitrógeno por molécula). Particularmente, del total de aminoácidos liberados por el músculo esquelético, la glutamina comprende el 48% mientras que la alanina un 32%. De hecho, el músculo esquelético necesita estar sintetizando constantemente glutamina y alanina, ya que la tasa de intercambio de dichos aminoácidos es mayor a su abundancia en el organismo, además de que se encuentran en la proteína muscular en un 10-15% aproximadamente. Asimismo, la síntesis de glutamina en el músculo esquelético es mayor a la de otros aminoácidos. Además, la glutamina junto a la alanina constituyen el ciclo de interconversión de aminoácidos, un proceso que es dependiente de las condiciones metabólicas, que a su vez dependen de otros factores, como el ejercicio físico y el estado nutricional (3).
HÍGADO:
En los hepatocitos, la glutamina es un factor clave en el metabolismo energético ya que es un precursor de la gluconeogénesis. Sabemos que, en pacientes críticos, el músculo esquelético es el principal tejido encargado de aportar glutamina, mientras que el hígado es el principal órgano que la consume. Como la glutamina es un aminoácido implicado en el metabolismo del nitrógeno, los hepatocitos captan glutamina para regular la actividad del ciclo de la urea. La glutamina se puede convertir en glutamato y NH3 gracias a la GLS (reacción comentada anteriormente). De esta manera, el hígado puede eliminar el NH3 empleando la glutamina (3).
La estructura del hígado permite este proceso merced a:
- Los hepatocitos periportales son los encargados de recibir la sangre y los nutrientes que provienen del intestino (contienen restos metabólicos tóxicos, como NH3 y NH4). Están ubicados cerca de la vena porta y presentan mayor expresión de la enzima GLS, además de enzimas que intervienen en el ciclo de la urea (9). Concretamente, se encargan de producir urea a partir de la glutamina (3).
- Los hepatocitos distales o perivenosos, se sitúan cerca de la vena hepática y presentan mayor cantidad de enzima GS. Por tanto, aprovechan los restos de NH3 y NH4 que se han escapado de la vía periportal para sintetizar la glutamina. De esta manera, se eliminan los restos tóxicos y se repone la glutamina necesaria (resíntesis de glutamina) (3).
Por tanto, el transporte de glutamina en los hepatocitos convierte los restos metabólicos tóxicos (NH3 y NH4) en urea, que se excreta y contribuye a mantener el equilibrio del pH sanguíneo (por los efectos sobre el bicarbonato). Este proceso recibe el nombre de ciclo intercelular de la glutamina o ciclo compartimentado del hígado y constituye una ruta por la que el hígado es capaz de eliminar amoníaco mediante la urea o sintetizar glutamina, dependiendo del estado ácido-base (3).
CÉLULAS INMUNES:
De manera general, en las células inmunitarias, la glucosa se convierte principalmente en lactato mediante la glucólisis, mientras que la glutamina se transforma en glutamato, aspartato y alanina en un proceso denominado glutaminolisis. Concretamente, las células del sistema inmune (linfocitos, neutrófilos, macrófagos) emplean glutamina en mayores cantidades que glucosa en condiciones de catabolismo (sepsis, desnutrición, ejercicio físico intenso…), por lo que una baja concentración sanguínea sería perjudicial para dichas células, además de relacionarse con un mayor riesgo de mortalidad (3).
En estados catabólicos, la alta demanda de glutamina por las células inmunes junto al mayor consumo por parte del hígado, entre otros tejidos y órganos, puede desencadenar un déficit de glutamina en el organismo. Por otro lado, se sabe que, en estos casos, el músculo esquelético (uno de los principales lugares de síntesis de glutamina) disminuye su capacidad de aportar este aminoácido al plasma (3).
Entre las causas por las que las concentraciones de glutamina pueden verse disminuídas, se encuentra el aumento de especies reactivas de oxígeno. En este sentido, las células del sistema inmune se ven afectadas ya que dependen enormemente de la disponibilidad de glutamina. Entre las consecuencias, se cita la disminución en la capacidad proliferativa de las células T y la menor capacidad fagocítica de los macrófagos, lo que puede llevar a la inmunosupresión (mayor facilidad para desarrollar infecciones, como aquellas que se relacionan con el tracto respiratorio superior) (2).
FUNCIONES
Las funciones con las que se ha relacionado la glutamina son las siguientes:
- Se encuentra implicada en la generación de energía (producción de ATP) y biosíntesis de nucleótidos (1).
- Es un precursor de otros compuestos, como aminoácidos (glutamato); componentes del ciclo de Krebs (α-cetoglutarato) (10) y nucleótidos (AMP, purinas y pirimidinas) (2,3) .
- Además de los BCAAs, la glutamina también activa la diana de rapamicina de los mamíferos (mTOR). Parece ser que cuando este aminoácido no se encuentra disponible, es la leucina (inductor anabólico en células musculares) la que activa la vía mTOR. Sin embargo, aunque la glutamina presente un papel en la regulación de la expresión de genes relacionados con el contenido muscular, no existe suficiente evidencia que apoye que la suplementación de glutamina por sí sola estimule el aumento de la masa muscular (3).
- Aporta carbono para la biosíntesis en el metabolismo celular (1)
- Proporciona nitrógeno (mediante la glutaminólisis), que es la fuente principal de nucleótidos, aminoácidos no esenciales y otros compuestos nitrogenados (1,10).
- Interviene en la donación de nitrógeno para producir NAD+. La baja actividad (que pueden derivarse de mutaciones) de la GS implica una síntesis deficiente de glutamina, lo que se traduce en una deficiencia de NAD+ (5).
- Se encuentra implicada en el transporte de amoníaco entre los tejidos y en la homeostasis del pH. De hecho, la glutamina constituye una forma de transporte no tóxica del NH3 (3).
Como las funciones más importantes de la glutamina suceden en la mitocondria, cualquier variación intracelular de esta conlleva a la disfunción mitocondrial y, en última instancia, a la muerte celular (1).
EJERCICIO FÍSICO Y GLUTAMINA
Desde hace ya tiempo, se sabe que el músculo esquelético presenta numerosas implicaciones desde el punto de vista bioquímico en el consumo de energía cuando está activo (glucosa y glucógeno, principalmente, y energía que procede de la acumulada en el tejido adiposo). Un sujeto entrenado, presenta una mejor defensa frente a las infecciones, ya que la práctica de actividad física desempeña un importante papel para el sistema inmunitario, aumentando la capacidad del organismo de luchar contras los patógenos. El factor clave entre la relación del sistema inmune y el músculo esquelético (encargado de la contracción muscular en el ejercicio físico) es la glutamina, ya que la disponibilidad de este aminoácido propicia un entorno favorable. En condiciones fisiológicas, el músculo secreta unas proteínas parecidas a las citocinas que se denominan mioquinas. Las células del sistema inmune son capaces de responder a las hormonas que se alteran por el ejercicio físico (por ejemplo, los leucocitos son afectados por la práctica de ejercicio físico[3], como el cortisol y la adrenalina. Además, también responden a las mioquinas. De esta manera, se preserva una comunicación con el músculo esquelético (2).
Se ha visto que, tras la práctica del ejercicio intenso de corta duración, los niveles de glutamina aumentan, mientras que después de un ejercicio intenso pero prolongado en el tiempo, los niveles disminuyen. Aunque los mecanismos por los que esto sucede aún no están bien dilucidados, se han propuesto los siguientes (2):
- Existe una alta demanda hepática y renal de glucosa, ya que son órganos dependientes de la gluconeogénesis.
- Las células inmunitarias aumentan su consumo de glutamina.
- Aparece un deterioro de los procesos que se encargan de liberar glutamina por parte del músculo además de una disminución en la síntesis de glutamina por parte de dicho tejido.
Como la disponibilidad de la glutamina es crucial para las células del sistema inmune, se comienza a pensar que su concentración plasmática podría ser un biomarcador de gravedad del ejercicio físico. Esto es, el músculo esquelético debe presentar una contracción adecuada que sea capaz de mantener unos niveles óptimos de glutamina para ser suministrada a las células inmunes. De hecho, la contracción muscular intensa afecta negativamente a la respuesta inmune ya que se agota la glutamina (es el principal sustrato para las células del sistema inmunitario), por lo que las células como los linfocitos, los macrófagos y los neutrófilos no pueden realizar su función de manera adecuada. Además, en situaciones extremas, el músculo esquelético comienza a utilizar la propia glutamina (se convierte en un órgano de consumo de glutamina además de sintetizarla), compitiendo con el sistema inmune por su utilización (2).
SUPLEMENTACIÓN CON GLUTAMINA
La mayoría de las personas pueden obtener suficiente glutamina a través de una dieta equilibrada y variada, por lo que su suplementación se considera más relevante en situaciones de estrés físico intenso, como entrenamientos intensos o enfermedades graves. De hecho, aún no existe suficiente evidencia que abale su empleo con el objetivo de restaurar la función inmune tras la práctica del ejercicio físico. Esto puede ser debido a la variabilidad de resultados ya que se desconoce la forma en la que se aporta el suplemento y su posible agrupación con otros (2). No obstante, se ha establecido una dosis de 20-30 g/día de glutamina (normalmente, 0.3-0.5 g).
Es importante añadir que antes de comenzar cualquier suplementación, se recomienda consultar con un profesional de la salud, como un médico o un dietista especializado en nutrición, para obtener orientación personalizada y segura.
BIBLIOGRAFÍA:
1. Shen Y, Zhang Y, Li W, Chen K, Xiang M, Ma H. Glutamine metabolism: from proliferating cells to cardiomyocytes. Metabolism [Internet]. 2021;121:154778.
2. Rogeri PS, Gasparini SO, Martins GL, Costa LKF, Araujo CC, Lugaresi R, et al. Crosstalk Between Skeletal Muscle and Immune System: Which Roles Do IL-6 and Glutamine Play? Front Physiol. 2020;11(October):1–11.
3. Cruzat V, Rogero MM, Keane KN, Curi R, Newsholme P. Glutamine: Metabolism and immune function, supplementation and clinical translation. Nutrients. 2018;10(11):1–31.
4. Jafari-Vayghan H, Varshosaz P, Hajizadeh-Sharafabad F, Razmi HR, Amirpour M, Tavakoli-Rouzbehani OM, et al. A comprehensive insight into the effect of glutamine supplementation on metabolic variables in diabetes mellitus: A systematic review. Nutr Metab (Lond). 2020;17(1):1–14.
5. Newsholme, P., Diniz, V. L. S., Dodd, G. T., & Cruzat, V. Glutamine metabolism and optimal immune and CNS function. Proceedings of the Nutrition Society. 2023;82(1), 22-31.
6. Apostolopoulou A, Haidich AB, Kofina K, Manzanares W, Bouras E, Tsaousi G, et al. Effects of glutamine supplementation on critically ill patients: Focus on efficacy and safety: An overview of systematic reviews. Nutrition. 2020;78.
7. Zhang S, Zeng X, Ren M, Mao X, Qiao S. Novel metabolic and physiological functions of branched chain amino acids: A review. J Anim Sci Biotechnol [Internet]. 2017;8(1):4–15.
8. Fister I, Fister I, Fister D. Sports Nutrition. Adaptation, Learning, and Optimization. 2019;22(i):247–77.
9. Frieg B, Görg B, Gohlke H, Häussinger D. Glutamine synthetase as a central element in hepatic glutamine and ammonia metabolism: Novel aspects. Biol Chem. 2021;402(9):1063–72.
10. Yoo HC, Yu YC, Sung Y, Han JM. Glutamine reliance in cell metabolism. Exp Mol Med [Internet]. 2020;52(9):1496–516.
[1] En estas situaciones, se ha visto que la concentración de glutamina en la sangre puede disminuir hasta un 30-45%, mientras que en el músculo esquelético puede disminuir hasta un 50%.
[2] El glutamato puede sintetizarse a través de dos vías: a partir del producto intermediario del ciclo de Krebs, el α-cetoglutarato (mediante la glutamato deshidrogenasa) o bien a partir del catabolismo de la leucina (aminoácido esencial de cadena ramificada)
[3] El ejercicio produce respuestas muy parecidas a las que se observan en pacientes tras sufrir traumatismos, sepsis o quemaduras graves, lo que lleva a respuestas inflamatorias.
Glutamina: Metabolismo, ejercicio físico y suplementación

Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de Madrid. Investigadora del Centro de Estudios Gregorio Marañón.
La glutamina es el aminoácido más abundante en el organismo (hasta el 40% de la reserva de aminoácidos libres en el músculo cardíaco) (1–3) y representa del 5 al 6% de los aminoácidos que se incorporan a las proteínas (aminoácidos proteinogénicos). Estructuralmente, está constituida por dos grupos aminos (grupo α-amino y grupo amida), por lo que resulta fundamental en el transporte de nitrógeno (3). De hecho, la proporción de glutamina que se encuentra libre en plasma constituye una de las principales fuentes de carbono y nitrógeno y, por lo general, se mantiene en concentraciones elevadas para proporcionar estos átomos imprescindibles en la biosíntesis (1).
Existen controversias al clasificar a la glutamina como aminoácido no esencial o condicionalmente esencial, ya que, aunque el cuerpo sea capaz de sintetizar glutamina, en condiciones de estrés (por ej., sepsis, infecciones, ejercicio intenso…) en los que la demanda del organismo se encuentra aumentada, la glutamina debe de obtenerse de fuentes exógenas (carne, pescado, lácteos, legumbres y nueces)[1] (2–4), aunque también puede requerirse un suplemento de glutamina con el fin de mantener las concentraciones plasmáticas en rangos fisiológicos (6).
METABOLISMO
El equilibrio entre la síntesis, liberación y captación de glutamina por parte de los órganos y tejidos determinan la concentración y disponibilidad de este aminoácido (5). Sabemos que ciertos órganos y tejidos humanos presentan una actividad de síntesis de glutamina específica, es el caso del hígado, músculo esquelético, tejido adiposo, cerebro y pulmones (3). Por tanto, las concentraciones de glutamina tisulares y en circulación sistémica dependen de la expresión o actividad de las enzimas implicadas en la producción (glutamina sintetasa, GS) (Figura 1) e hidrólisis (glutaminasa, GLS) de la misma (Figura 2). Dentro de la célula, la GS se encuentra en el citosol ya que produce glutamina para la síntesis de proteínas y nucleótidos citoplasmáticos, mientras que la GLS se sitúa en la mitocondria, principalmente, ya que cataliza la conversión de glutamina en glutamato para que este después entre en el ciclo de Krebs (3). En concreto, el glutamato junto al amoníaco (NH3) y ATP forman la glutamina, que después es liberada y transportada al plasma.

Figura 1. Síntesis de glutamina por la glutamina sintetasa (GS).
La GLS cataliza la reacción inversa, la hidrólisis de glutamina en glutamato produciendo amonio (NH4) (1–3). Por tanto, indirectamente, la producción de glutamina es dependiente de la disponibilidad de glutamato[2] (3).

Figura 2. Hidrólisis de la glutamina por la glutaminasa (GLS).
A este respecto, resulta importante distinguir los organismos y tejidos humanos encargados de sintetizar y degradar glutamina en estado fisiológico y patológico (3):
- Cerebro y riñones: no presentan GS, por lo que son dependientes de la disponibilidad de glutamina plasmática tanto en condiciones fisiológicas como patológicas.
- Pulmones y tejido adiposo: presentan GS y GLS, por lo que son capaces de sintetizar y degradar glutamina en ambas condiciones.
- Intestino: es el órgano de mayor consumo de glutamina (7). Sin embargo, cuando existe una patología, se incrementa el consumo de glutamina en comparación con los estados libres de enfermedad.
- Las células del sistema inmune son altamente dependientes de glucosa y glutamina en estado fisiológico, pero incluso más en estados patológicos.
- El hígado y el músculo esquelético son los almacenes de glutamina por excelencia. En condiciones fisiológicas, tanto el hígado como el músculo esquelético pueden sintetizar glutamina ya que presentan GS, pero en estados catabólicos (ingesta reducida de HC y/o aminoácidos, estrés…) el hígado consume glutamina (gracias a que posee GLS) y el músculo esquelético es capaz de sintetizar glutamina (porque exhibe GS).
HOMEOSTASIS DE LA GLUTAMINA EN DISTINTOS ÓRGANOS
INTESTINO:
La glutamina es necesaria para el mantenimiento de la barrera intestinal y el funcionamiento adecuado del revestimiento del tracto gastrointestinal. Puede ayudar a mantener la integridad del intestino y mejorar la absorción de nutrientes. De hecho, en este órgano resulta cuantitativamente más notable que la glucosa en cuanto a sustrato energético. Particularmente, los enterocitos metabolizan el carbono de la glutamina mediante dos vías principales (3):
- Formación de δ-1-pirrolina-5-carboxilato, que conlleva la síntesis de prolina, ornitina y citrulina a partir del carbono de la glutamina. Para este proceso se emplea aproximadamente el 10% de la concentración de aminoácidos que se encuentra en el intestino.
- Mediante la conversión en α-cetoglutarato (intermediario en el ciclo de Krebs).
Aunque un 10-15% de la glutamina se incorpora a la proteína que forma parte de los tejidos, la mayor proporción (se estima que un 75%) es metabolizada en el ciclo de Krebs para producir ATP (3). Por tanto, en el intestino, la concentración de glutamina es baja, debido a la alta actividad de la GLS y a la elevada afinidad de la enzima por su sustrato (3).
Las células intestinales se encuentran unidas a la membrana de la mitocondria, y en estas se halla la GLS, de modo que, en este tejido es de especial interés mantener una correcta modulación de la actividad de este enzima para prevenir la traslocación bacteriana así como promover una adecuada absorción de nutrientes. A este respecto, se encuentran descritos en la literatura científica reciente como la actividad de la GLS es menor, es el caso del ayuno prolongado o los estados de malnutrición, mientras que tras la administración de BCAAs, L-alanil-L-glutamina o en el periodo posprandial, la actividad de la enzima está aumentada (3).
MÚSCULO ESQUELÉTICO:
Como se ha señalado, el músculo esquelético, junto al hígado, son los mayores reservorios de glutamina. Por su parte, el músculo esquelético está implicado en la síntesis, almacenamiento y liberación de glutamina. No obstante, la actividad de la GS es baja. En consecuencia, el tejido muscular tiene una gran influencia en la disponibilidad de la glutamina en el organismo. Se estima que el 80% de la glutamina se encuentra en el tejido muscular esquelético (30 veces más que en el plasma) y que el contenido de glutamina dentro del músculo comprende entre el 50-60% de la reserva total de aminoácidos libres del tejido muscular esquelético (3,8).
En el musculo esquelético, existen dos tipos de fibras en las que se encuentran diferencias en cuanto a la concentración de glutamina; las fibras tipo 1 (fibras oxidativas) y fibras tipo 2 (fibras glucolíticas). Las primeras son las que mayor concentración presentan (hasta tres veces más) debido a que cuentan con más GS y, mayor disponibilidad de ATP, a diferencia de las fibras tipo 2. De esto, deducimos que la concentración de glutamina varía según el tipo de fibras musculares (2,3,5). Por último, añadir que el músculo esquelético es capaz de liberar glutamina a la circulación sistémica a razón de 7.300.000 ng/ml por hora (8).
Factores que estimulan la liberación de glutamina en el músculo esquelético:
Los glucocorticoides impulsan la liberación de glutamina al espacio extracelular, en tanto que las hormonas (insulina y los factores de crecimiento similares a la insulina (IGF)) estimulan el transporte de glutamina al medio intracelular. Existen unos canales dependientes de sodio que transportan la glutamina al interior de las células (con consumo de ATP). Dicho transporte es más rápido que el transporte del resto de aminoácidos. No obstante, mantener una disponibilidad de glutamina constante en el contenido intracelular y un correcto funcionamiento del gradiente transmembrana resulta un reto, debido a la cantidad de factores que intervienen, como la competencia de otros aminoácidos por unirse a los transportadores o la misma afinidad de la glutamina por su unión al transportador (3).
En el musculo esquelético y en estados post-absortivos, se consigue sintetizar aproximadamente el 50% de glutamina gracias a la captación de glutamato, que mediante la GS se convierte en glutamina. No obstante, otras maneras de sintetizar glutamina consisten en el catabolismo de proteínas musculares y en la liberación de aminoácidos cuyos esqueletos de carbono se emplean para formar glutamina “de novo” (como aminoácidos esenciales de cadena ramificada, aspartato, asparagina y glutamato) (3).
En este punto, cabe mencionar el ciclo alanina-glutamina que tiene lugar en el músculo esquelético:
En el estado de post-absorción, la glutamina libera nitrógeno al músculo esquelético (debido a que contiene dos átomos de nitrógeno por molécula). Particularmente, del total de aminoácidos liberados por el músculo esquelético, la glutamina comprende el 48% mientras que la alanina un 32%. De hecho, el músculo esquelético necesita estar sintetizando constantemente glutamina y alanina, ya que la tasa de intercambio de dichos aminoácidos es mayor a su abundancia en el organismo, además de que se encuentran en la proteína muscular en un 10-15% aproximadamente. Asimismo, la síntesis de glutamina en el músculo esquelético es mayor a la de otros aminoácidos. Además, la glutamina junto a la alanina constituyen el ciclo de interconversión de aminoácidos, un proceso que es dependiente de las condiciones metabólicas, que a su vez dependen de otros factores, como el ejercicio físico y el estado nutricional (3).
HÍGADO:
En los hepatocitos, la glutamina es un factor clave en el metabolismo energético ya que es un precursor de la gluconeogénesis. Sabemos que, en pacientes críticos, el músculo esquelético es el principal tejido encargado de aportar glutamina, mientras que el hígado es el principal órgano que la consume. Como la glutamina es un aminoácido implicado en el metabolismo del nitrógeno, los hepatocitos captan glutamina para regular la actividad del ciclo de la urea. La glutamina se puede convertir en glutamato y NH3 gracias a la GLS (reacción comentada anteriormente). De esta manera, el hígado puede eliminar el NH3 empleando la glutamina (3).
La estructura del hígado permite este proceso merced a:
- Los hepatocitos periportales son los encargados de recibir la sangre y los nutrientes que provienen del intestino (contienen restos metabólicos tóxicos, como NH3 y NH4). Están ubicados cerca de la vena porta y presentan mayor expresión de la enzima GLS, además de enzimas que intervienen en el ciclo de la urea (9). Concretamente, se encargan de producir urea a partir de la glutamina (3).
- Los hepatocitos distales o perivenosos, se sitúan cerca de la vena hepática y presentan mayor cantidad de enzima GS. Por tanto, aprovechan los restos de NH3 y NH4 que se han escapado de la vía periportal para sintetizar la glutamina. De esta manera, se eliminan los restos tóxicos y se repone la glutamina necesaria (resíntesis de glutamina) (3).
Por tanto, el transporte de glutamina en los hepatocitos convierte los restos metabólicos tóxicos (NH3 y NH4) en urea, que se excreta y contribuye a mantener el equilibrio del pH sanguíneo (por los efectos sobre el bicarbonato). Este proceso recibe el nombre de ciclo intercelular de la glutamina o ciclo compartimentado del hígado y constituye una ruta por la que el hígado es capaz de eliminar amoníaco mediante la urea o sintetizar glutamina, dependiendo del estado ácido-base (3).
CÉLULAS INMUNES:
De manera general, en las células inmunitarias, la glucosa se convierte principalmente en lactato mediante la glucólisis, mientras que la glutamina se transforma en glutamato, aspartato y alanina en un proceso denominado glutaminolisis. Concretamente, las células del sistema inmune (linfocitos, neutrófilos, macrófagos) emplean glutamina en mayores cantidades que glucosa en condiciones de catabolismo (sepsis, desnutrición, ejercicio físico intenso…), por lo que una baja concentración sanguínea sería perjudicial para dichas células, además de relacionarse con un mayor riesgo de mortalidad (3).
En estados catabólicos, la alta demanda de glutamina por las células inmunes junto al mayor consumo por parte del hígado, entre otros tejidos y órganos, puede desencadenar un déficit de glutamina en el organismo. Por otro lado, se sabe que, en estos casos, el músculo esquelético (uno de los principales lugares de síntesis de glutamina) disminuye su capacidad de aportar este aminoácido al plasma (3).
Entre las causas por las que las concentraciones de glutamina pueden verse disminuídas, se encuentra el aumento de especies reactivas de oxígeno. En este sentido, las células del sistema inmune se ven afectadas ya que dependen enormemente de la disponibilidad de glutamina. Entre las consecuencias, se cita la disminución en la capacidad proliferativa de las células T y la menor capacidad fagocítica de los macrófagos, lo que puede llevar a la inmunosupresión (mayor facilidad para desarrollar infecciones, como aquellas que se relacionan con el tracto respiratorio superior) (2).
FUNCIONES
Las funciones con las que se ha relacionado la glutamina son las siguientes:
- Se encuentra implicada en la generación de energía (producción de ATP) y biosíntesis de nucleótidos (1).
- Es un precursor de otros compuestos, como aminoácidos (glutamato); componentes del ciclo de Krebs (α-cetoglutarato) (10) y nucleótidos (AMP, purinas y pirimidinas) (2,3) .
- Además de los BCAAs, la glutamina también activa la diana de rapamicina de los mamíferos (mTOR). Parece ser que cuando este aminoácido no se encuentra disponible, es la leucina (inductor anabólico en células musculares) la que activa la vía mTOR. Sin embargo, aunque la glutamina presente un papel en la regulación de la expresión de genes relacionados con el contenido muscular, no existe suficiente evidencia que apoye que la suplementación de glutamina por sí sola estimule el aumento de la masa muscular (3).
- Aporta carbono para la biosíntesis en el metabolismo celular (1)
- Proporciona nitrógeno (mediante la glutaminólisis), que es la fuente principal de nucleótidos, aminoácidos no esenciales y otros compuestos nitrogenados (1,10).
- Interviene en la donación de nitrógeno para producir NAD+. La baja actividad (que pueden derivarse de mutaciones) de la GS implica una síntesis deficiente de glutamina, lo que se traduce en una deficiencia de NAD+ (5).
- Se encuentra implicada en el transporte de amoníaco entre los tejidos y en la homeostasis del pH. De hecho, la glutamina constituye una forma de transporte no tóxica del NH3 (3).
Como las funciones más importantes de la glutamina suceden en la mitocondria, cualquier variación intracelular de esta conlleva a la disfunción mitocondrial y, en última instancia, a la muerte celular (1).
EJERCICIO FÍSICO Y GLUTAMINA
Desde hace ya tiempo, se sabe que el músculo esquelético presenta numerosas implicaciones desde el punto de vista bioquímico en el consumo de energía cuando está activo (glucosa y glucógeno, principalmente, y energía que procede de la acumulada en el tejido adiposo). Un sujeto entrenado, presenta una mejor defensa frente a las infecciones, ya que la práctica de actividad física desempeña un importante papel para el sistema inmunitario, aumentando la capacidad del organismo de luchar contras los patógenos. El factor clave entre la relación del sistema inmune y el músculo esquelético (encargado de la contracción muscular en el ejercicio físico) es la glutamina, ya que la disponibilidad de este aminoácido propicia un entorno favorable. En condiciones fisiológicas, el músculo secreta unas proteínas parecidas a las citocinas que se denominan mioquinas. Las células del sistema inmune son capaces de responder a las hormonas que se alteran por el ejercicio físico (por ejemplo, los leucocitos son afectados por la práctica de ejercicio físico[3], como el cortisol y la adrenalina. Además, también responden a las mioquinas. De esta manera, se preserva una comunicación con el músculo esquelético (2).
Se ha visto que, tras la práctica del ejercicio intenso de corta duración, los niveles de glutamina aumentan, mientras que después de un ejercicio intenso pero prolongado en el tiempo, los niveles disminuyen. Aunque los mecanismos por los que esto sucede aún no están bien dilucidados, se han propuesto los siguientes (2):
- Existe una alta demanda hepática y renal de glucosa, ya que son órganos dependientes de la gluconeogénesis.
- Las células inmunitarias aumentan su consumo de glutamina.
- Aparece un deterioro de los procesos que se encargan de liberar glutamina por parte del músculo además de una disminución en la síntesis de glutamina por parte de dicho tejido.
Como la disponibilidad de la glutamina es crucial para las células del sistema inmune, se comienza a pensar que su concentración plasmática podría ser un biomarcador de gravedad del ejercicio físico. Esto es, el músculo esquelético debe presentar una contracción adecuada que sea capaz de mantener unos niveles óptimos de glutamina para ser suministrada a las células inmunes. De hecho, la contracción muscular intensa afecta negativamente a la respuesta inmune ya que se agota la glutamina (es el principal sustrato para las células del sistema inmunitario), por lo que las células como los linfocitos, los macrófagos y los neutrófilos no pueden realizar su función de manera adecuada. Además, en situaciones extremas, el músculo esquelético comienza a utilizar la propia glutamina (se convierte en un órgano de consumo de glutamina además de sintetizarla), compitiendo con el sistema inmune por su utilización (2).
SUPLEMENTACIÓN CON GLUTAMINA
La mayoría de las personas pueden obtener suficiente glutamina a través de una dieta equilibrada y variada, por lo que su suplementación se considera más relevante en situaciones de estrés físico intenso, como entrenamientos intensos o enfermedades graves. De hecho, aún no existe suficiente evidencia que abale su empleo con el objetivo de restaurar la función inmune tras la práctica del ejercicio físico. Esto puede ser debido a la variabilidad de resultados ya que se desconoce la forma en la que se aporta el suplemento y su posible agrupación con otros (2). No obstante, se ha establecido una dosis de 20-30 g/día de glutamina (normalmente, 0.3-0.5 g).
Es importante añadir que antes de comenzar cualquier suplementación, se recomienda consultar con un profesional de la salud, como un médico o un dietista especializado en nutrición, para obtener orientación personalizada y segura.
BIBLIOGRAFÍA:
1. Shen Y, Zhang Y, Li W, Chen K, Xiang M, Ma H. Glutamine metabolism: from proliferating cells to cardiomyocytes. Metabolism [Internet]. 2021;121:154778.
2. Rogeri PS, Gasparini SO, Martins GL, Costa LKF, Araujo CC, Lugaresi R, et al. Crosstalk Between Skeletal Muscle and Immune System: Which Roles Do IL-6 and Glutamine Play? Front Physiol. 2020;11(October):1–11.
3. Cruzat V, Rogero MM, Keane KN, Curi R, Newsholme P. Glutamine: Metabolism and immune function, supplementation and clinical translation. Nutrients. 2018;10(11):1–31.
4. Jafari-Vayghan H, Varshosaz P, Hajizadeh-Sharafabad F, Razmi HR, Amirpour M, Tavakoli-Rouzbehani OM, et al. A comprehensive insight into the effect of glutamine supplementation on metabolic variables in diabetes mellitus: A systematic review. Nutr Metab (Lond). 2020;17(1):1–14.
5. Newsholme, P., Diniz, V. L. S., Dodd, G. T., & Cruzat, V. Glutamine metabolism and optimal immune and CNS function. Proceedings of the Nutrition Society. 2023;82(1), 22-31.
6. Apostolopoulou A, Haidich AB, Kofina K, Manzanares W, Bouras E, Tsaousi G, et al. Effects of glutamine supplementation on critically ill patients: Focus on efficacy and safety: An overview of systematic reviews. Nutrition. 2020;78.
7. Zhang S, Zeng X, Ren M, Mao X, Qiao S. Novel metabolic and physiological functions of branched chain amino acids: A review. J Anim Sci Biotechnol [Internet]. 2017;8(1):4–15.
8. Fister I, Fister I, Fister D. Sports Nutrition. Adaptation, Learning, and Optimization. 2019;22(i):247–77.
9. Frieg B, Görg B, Gohlke H, Häussinger D. Glutamine synthetase as a central element in hepatic glutamine and ammonia metabolism: Novel aspects. Biol Chem. 2021;402(9):1063–72.
10. Yoo HC, Yu YC, Sung Y, Han JM. Glutamine reliance in cell metabolism. Exp Mol Med [Internet]. 2020;52(9):1496–516.
[1] En estas situaciones, se ha visto que la concentración de glutamina en la sangre puede disminuir hasta un 30-45%, mientras que en el músculo esquelético puede disminuir hasta un 50%.
[2] El glutamato puede sintetizarse a través de dos vías: a partir del producto intermediario del ciclo de Krebs, el α-cetoglutarato (mediante la glutamato deshidrogenasa) o bien a partir del catabolismo de la leucina (aminoácido esencial de cadena ramificada)
[3] El ejercicio produce respuestas muy parecidas a las que se observan en pacientes tras sufrir traumatismos, sepsis o quemaduras graves, lo que lleva a respuestas inflamatorias.
Otras Noticias

Encuentros con expertos: La sanidad española mirando al futuro
“La Sanidad española mirando al futuro”, un ciclo de encuentros con expertos que muestra casos…

Triptófano y sus metabolitos
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense…

BCAAs y sus aplicaciones clínicas
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

La colina como biomarcador
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de…
Noticias relacionadas

Encuentros con expertos: La sanidad española mirando al futuro
“La Sanidad española mirando al futuro”, un ciclo de encuentros con expertos que muestra casos…

Triptófano y sus metabolitos
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense…

BCAAs y sus aplicaciones clínicas
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

La colina como biomarcador
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de…




