BCAAs y sus aplicaciones clínicas

Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de Madrid. Investigadora del Centro de Estudios Gregorio Marañón.
ABREVIATURAS: Aminoácidos (AA); Branched Chain Amino-Acids, de sus siglas en inglés BCAAs (aminoácidos esenciales de cadena ramificada); proteína quinasa activada por AMP (AMPK); ciclo del ácido tricarboxílico (CAT); diabetes mellitus tipo 2 (DMT2); aminoácido ramificado aminotransferasa (de sus siglas en inglés, branched chain amino acid transferasa, BCAT); complejo de la cetoácido de cadena ramificada deshidrogenasa (de sus siglas en inglés, branched chain α-keto acid dehydrogenase, BCKDH); proteína de unión al elemento de respuesta a glúcidos (ChREBP-β); 3-hidroxi-isobutirato (3-HIB).
GENERALIDADES DE LOS AMINOÁCIDOS ESENCIALES DE CADENA RAMIFICADA (BCAAs)
La valina, leucina e isoleucina conforman los denominados aminoácidos esenciales de cadena ramificada (Branched Chain Amino-Acids, de sus siglas en inglés BCAAs), compuestos obtenidos a partir de alimentos ricos en proteínas, como la carne, huevos, lácteos o legumbres, entre otros. Del total de las proteínas alimentarias, éstos constituyen aproximadamente el 20-25% (los más abundantes) (1) y la proporción en la que se encuentran (Leucina:Isoleucina:Valina) varía entre 2:1:1 o 1,6:2,2:1 (1). En cambio, los BCAAs libres que se encuentran formando parte del pool de aminoácidos del músculo esquelético son de aproximadamente 0,65 milimolar, en una proporción de 2:1:3[1]. En cuanto al total de los aminoácidos esenciales de los mamíferos, el porcentaje de BCAAs representa el 35% (2,3).
Entre sus funciones principales destaca la de ser reguladores clave de la síntesis de proteínas, obviando el metabolismo hepático, por lo que se encuentran rápidamente disponibles en circulación tras su ingesta (4–6). Además, para la síntesis proteica se necesita de la biodisponibilidad de todos los aminoácidos, esto es, en el momento en el que exista una deficiente de algún grupo de aminoácidos (esenciales o no esenciales), no podrá ser llevado a cabo este proceso, metabolizándose el grupo de aminoácidos que se encuentre en exceso y almacenándose en forma de glucógeno (1)
Los BCAAs pueden ser sustratos gluconeogénicos y cetogénicos, concretamente la leucina es cetogénica, la valina es gluconeogénica, mientras que la isoleucina puede ser tanto cetogénica como gluconeogénica (1).
METABOLISMO DE LOS BCAAs
El inicio del metabolismo de los BCAAs comienza en el músculo esquelético y no en el hígado, lo que representa una diferencia con el resto de aminoácidos (1). No obstante, como se ha mencionado anteriormente, los BCAAs obvian el metabolismo hepático debido a la baja actividad de la enzima aminoácido ramificado aminotransferasa (Branched Chain Aminoacid Transferasa, de sus siglas en inglés, BCAT),encargada de catalizar el primer paso de degradación de los BCAAs en α-cetoácidos de cadena ramificada[2] (branched chain ketoacids, de sus siglas en inglés BCKAs). Concretamente, la leucina se transforma en α-cetoisocaproato, la valina en α-cetoisovalerato y la isoleucina en α-cetometilvalerato[3]. Como las BCAT se encuentran principalmente en el músculo esquelético, este tejido representa el lugar más importante para el metabolismo de los BCAAs. Se estima que más de la mitad del total de BCAAs circulantes terminan por entrar en el músculo, una cuarta parte entra en la circulación esplácnica y el resto va a parar al cerebro y otros tejidos. Una vez convertidos en BCKAs, pueden seguir dos vías: reacciones enzimáticas de tipo irreversible o pasar a la circulación para degradarse en otros tejidos (7). No obstante, como el músculo esquelético es un tejido de tipo no gluconeogénico, los BCAAs deben ser eliminados (en forma de BCAAs o en forma de sus metabolitos) en el caso de que no puedan catabolizarse plenamente por los músculos. Seguidamente, actúa la α-cetoácido de cadena ramificada deshidrogenasa (Branched Chain α-Ketoacid DeHydrogenase, de sus siglas en inglés BCKDH), enzima responsable del paso limitante en la velocidad del catabolismo de los BCAAs. Se sabe que en el hígado y en el corazón los niveles de dicha enzima son más altos, mientras que en el músculo esquelético son más bajos. La BCKDH[4] transforma los BCKAs en productos finales (acil-CoA) y el músculo esquelético los libera a la circulación. En este punto, dichos metabolitos pueden seguir dos rutas (1,7): (1); entrar en el Ciclo de Krebs y (2); almacenarse en forma de glucógeno o en forma de triglicéridos.
En resumen, a diferencia de otros aminoácidos en los que su metabolismo tiene lugar principalmente en el hígado, los BCAAs se metabolizan en tejidos periféricos, como el músculo. Por tanto, los BCAAs no se degradan en el hígado. No obstante, es importante señalar que una vez que estos se transforman en BCKAs en otros tejidos, el hígado sí que tiene capacidad para oxidarlos (6,8).
FUNCIONES DE LOS BCAAs
Las funciones principales de estos aminoácidos son las siguientes:
- Son moléculas de señalización implicadas en la síntesis de proteínas (1). Asimismo, los BCAA libres que proceden de la reserva de aminoácidos de los tejidos funcionan como reguladores del metabolismo proteico y energético (3).
- En estados de ayuno, pueden ser degradados para la obtención de energía (1).
- Tras la ingesta, los BCAAs sirven como sustratos para la síntesis proteica (1,9).
- Por tanto, los niveles de BCAAs en sangre postprandiales se corresponden con la ingesta de proteínas alimentarias, a diferencia de los niveles en ayunas, que están regulados por su capacidad de catabolismo.
- Son capaces de incrementar el contenido mitocondrial en tejidos como el músculo esquelético y el tejido adiposo, lo que mejora la capacidad oxidativa (10)
- Se emplean como donantes de grupos amino para sintetizar glutamato en el cerebro (3).
- Pueden oxidarse a través de la señalización del AMPK (proteína quinasa activada por AMP, un sensor del equilibrio energético) para generar energía (en forma de ATP). El carbono procedente de la leucina entra en el ciclo del ácido tricarboxílico (CAT) en forma de acetil-CoA para eliminarse como CO2, mientras que la isoleucina y la valina proporcionan principalmente carbono para la conversión anaplerótica de propionil-CoA en succinil-CoA (4,9,11) (Figura 1).
- Por otro lado, los BCAAs pueden dirigirse a la síntesis de proteínas (en condiciones anabólicas) a través de la activación de la proteína quinasa MTORC1[5] (10), aumentando la expresión de los genes que codifican las enzimas que se encargan de la síntesis de lípidos. Concentraciones elevadas de BCAAs activan permanentemente este complejo, con la consecuente acumulación de triglicéridos en el tejido adiposo, hígado y músculo, lo que contribuye al estado de resistencia a la insulina y diabetes (4,5). Particularmente, de los tres aminoácidos, se conoce que la leucina es el más notable activando la vía de señalización MTORC1 (8).
POSIBLES APLICACIONES CLÍNICAS DE LOS BCAAs. DIABETES MELLITUS TIPO 2, OBESIDAD Y RESISTENCIA A LA INSULINA
La prevalencia de la diabetes mellitus tipo 2 (DMT2) está aumentando en todo el mundo. Las cifras de 2014 (Organización Mundial de la Salud, OMS) indican una elevación de 314 millones de personas desde 1980. El rasgo más característico de la DMT2 es el síndrome metabólico, que aumenta el riesgo de padecer otro tipo de enfermedades, entre las que se citan el cáncer, los trastornos neurodegenerativos y anomalías metabólicas (12–14)
Un fenómeno de importante relevancia en la DMT2 es el denominado resistencia a la insulina. Se trata de un estado en el que se necesita mayor cantidad insulina para conseguir los mismos efectos biológicos producidos por una menor cantidad de insulina en un estado libre de enfermedad. La resistencia a la insulina implica el deterioro de varios de los mecanismos a través de los cuales la insulina ejerce sus efectos metabólicos: cambios en los niveles de proteínas, cambios en las actividades de las enzimas de señalización y de factores de transcripción. Se conoce que existen factores genéticos que predisponen a la DMT2, pero, la mayoría de los individuos obesos no desarrollan diabetes tipo 2, aunque gran parte de diabéticos tipo 2 sean obesos. La genética de la diabetes es compleja e incluye interacciones entre genes variables y factores ambientales, entre los que se cuentan la dieta y el estilo de vida. A este respecto, algunos de los tratamientos propuestos para mejorar la salud de los pacientes diabéticos tipo 2 son la pérdida de peso y el ejercicio. Se ha visto que una pérdida de peso reduce el contenido de triglicéridos en el tejido adiposo, lo que restablece la sensibilidad a la insulina. Desde otro punto de vista, el ejercicio activa la AMPK a través de la conversión de ATP en ADP y AMP, favoreciendo la pérdida de peso.
Relación entre la resistencia a la insulina y los BCAAs
Como se ha mencionado anteriormente, el catabolismo de los BCAAs ocurre principalmente en los tejidos hepático, muscular y adiposo, los cuales contienen la BCAT que produce los BCKAs correspondientes (α-cetoisocaproato, de leucina; α-cetoisovalerato, de valina y α-ceto-metilvalerato, de isoleucina) (Figura 1) cuya reacción es reversible (6). Además, presentan la BCKDH, que cataliza la carboxilación oxidativa de los tres BCKAs produciendo el derivado acil-CoA correspondiente en cada caso, que posteriormente entra en el CAT para su oxidación (4) En definitiva, la degradación de cada uno de los BCAAs lleva a la formación de productos intermedios y finales distintos, aunque compartan varios pasos en el catabolismo (15). No obstante, el catabolismo en cada órgano presenta algunas diferencias por lo que, en el siguiente apartado se exponen losmecanismos propuestos para explicar la relación entre la resistencia a la insulina con los BCAAs.
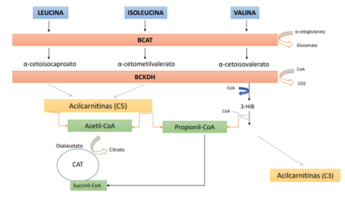
Figura 1. Metabolismo de los BCAAs. BCAT: Aminoácido ramificado aminotransferasa; BCKDH: Complejo de la α-cetoácido de cadena ramificada deshidrogenasa; CAT: Ciclo del ácido tricarboxilico; 3-Hib: 3-hidroxi-isobutirato.
TEJIDO HEPÁTICO: en este órgano, existe una mayor fosforilación de la BCKDH, que se regula por un factor de transcripción denominado ChREBP-β (proteína de unión al elemento de respuesta a glúcidos), el cual es sensible a la ingesta de hidratos de carbono de tipo simples, como la fructosa. A este respecto, se ha relacionado una dieta rica en fructosa con la elevación de BCAAs en plasma, que posteriormente pasarán al tejido periférico provocando que el catabolismo posterior aumente. En consecuencia, se producirá una cantidad excesiva de acil-CoA, lo que supera el potencial oxidativo de las mitocondrias y perjudica al desarrollo del CAT (ya que se reduce la capacidad del hígado para oxidar los ácidos grasos y la glucosa) provocando que se acumulen unos intermediarios catabólicos, denominados acilcarnitinas, que llevan al estrés oxidativo mitocondrial perjudicando la homeostasis de la glucosa e induciendo la resistencia hepática a la insulina (11). Por otro lado, el exceso de acil-CoA promueve la lipogénesis y gluconeogénesis, lo que genera más resistencia a la insulina. De este mecanismo se deriva la siguiente conclusión, la resistencia a la insulina no es causada directamente por los BCKAs, sino que su descomposición conduce a la acumulación de acilcarnitinas resultando en un estrés oxidativo mitocondrial y causando, en definitiva, la resistencia a la insulina en el hígado (9,13).
TEJIDO ADIPOSO: aunque el mecanismo no es convincente, se sugiere que, si el catabolismo de los BCAAs en el tejido adiposo está inhibido, se promueve la resistencia a la insulina. Esto provoca que los niveles de BCAAs aumenten en plasma, obligando, principalmente, al músculo y al hígado a descomponerlos y, provocando, en última instancia, resistencia a la insulina por el mismo mecanismo que se ha comentado en el anterior caso (13,16). Además, se sabe que la leucina es capaz de activar e inhibir la síntesis y degradación de proteínas en el tejido adiposo a través de la señalización de MTOR (16). Desde otro ángulo, la leucina puede estimular la liberación de insulina en las células β pancreáticas (5) y la liberación de hormonas implicadas en la saciedad y el apetito (ghrelina y leptina), dando como resultado una disminución en el apetito y una reducción en la adiposidad (12). Asimismo, existe otra hipótesis menos estudiada que menciona la disfunción en la enzima deshidrogenasa del tejido adiposo (9), la cual parece contribuir al aumento en las concentraciones plasmáticas de BCAAs. Esta disfunción conduce a la formación de BCKAs que causan estrés oxidativo mitocondrial, de la misma manera que sucede en pacientes que sufren la enfermedad del jarabe de arce en la orina[6] (17).
MÚSCULO ESQUELÉTICO: aunque la expresión de la BCKDH en este órgano es baja, también existe una sobrecarga lipídica que provoca daño mitocondrial y resistencia a la insulina[7]. La insulina impide la degradación proteica, pero, en un estado de resistencia a la insulina, en el que ésta pierde la total capacidad de su función, la degradación proteica en el musculo esquelético no ocurre, con el consecuente aumento en la tasa de aparición de los BCAAs en plasma (9). En otro orden de ideas, el 3-hidroxi-isobutirato (3-HIB), un intermediario que se produce en la descomposición de la valina, promueve la captación de ácidos grasos en el músculo esquelético dando lugar a una acumulación de acilcarnitinas (5,13). Como los músculos no son un tejido gluconeogénico; y la valina y la isoleucina deben convertirse en glucosa, no pueden metabolizarse completamente en este órgano. No obstante, el 3-HIB, que carece de enlace covalente con la Coenzima A (CoA), sale de los miocitos y actúa como sustrato gluconeogénico (ya que puede escapar de la mitocondria, a diferencia de los otros metabolitos catabólicos de los BCAAs que están unidos covalentemente a la CoA) promoviendo el flujo de ácidos grasos al músculo esquelético y acumulándose las especies lipídicas intermediarios que promueven la resistencia a la insulina (1,2,4,11). Otro mecanismo implicado para tratar de explicar por qué el aumento del flujo del catabolismo de BCAAs en el músculo esquelético se relaciona con el desarrollo de la resistencia a la insulina es que el exceso de catabolismo de BCAAs por parte del músculo esquelético termina por consumir la glicina de dentro de la célula, disminuyendo la salida (exportación) de compuestos de acil-glicina, y acumulándose las especies de acil-CoA grasos (2). Por último, se comenta que el incremento en la degradación de BCAAs podría estar relacionado con la resistencia a la insulina por la activación de MTORC1, un regulador de la señalización de la insulina y el metabolismo del músculo esquelético, pero aún se desconoce si la activación de este complejo por los BCAAs es capaz y suficiente para estimular la resistencia a la insulina (2,8).
Con todo lo comentado, en los últimos años los BCAAs y sus derivados se han propuesto como biomarcadores de DMT2 (1,4,13–15,18–30) debido a la elevación en sus niveles plasmáticos en pacientes con dicha enfermedad. Este aumento catabólico de los BCAAs contribuye al aumento de la gluconeogénesis y la intolerancia a la glucosa (3,9,11,19,29,31), lo que constituye un factor de riesgo para desarrollar en un futuro resistencia a la insulina y, posteriormente, DMT2 (5,9,16,21,29,32,33).
A este respecto, numerosos autores señalan que las concentraciones plasmáticas de BCAAs constituyen un biomarcador de detección temprana para detectar una posible diabetes, mucho antes de que la insuficiencia en las células β pancreáticas, responsables de segregar la insulina, se produzca. Concretamente, se sugiere que los niveles de BCAAs predicen el riesgo de DMT2 incidente hasta doce años antes de su manifestación (5,11,16,19,20).
No obstante, aún existe mucha controversia acerca de si los niveles elevados de BCAAs se consideran biomarcadores que se alteran como consecuencia de la resistencia a la insulina o si, por el contrario, su incremento contribuye a la aparición de la resistencia a la insulina (1,2). El principal problema reside en que los estudios científicos aún no dan resultados demasiado concluyentes, esto es, se desconoce si una reducción dietética de los BCAAs (al ser estos aminoácidos esenciales y depender de la fuente dietética) podría revertir la resistencia a la insulina (25). En principio, se pensaba que la elevación de BCAAs era consecuencia de un aumento en la ingesta proteica, pero estudios epidemiológicos han señalado que el aumento del consumo diario se debe al incremento de los hidratos de carbono más que de las proteínas (17) ya que una dieta con alto aporte de proteína animal o vegetal no aumenta la resistencia a la insulina (17,25), probablemente porque cualquier aumento excesivo en la ingesta de proteínas conlleva un posterior catabolismo, al contrario de lo que ocurre con los otros grupos de macronutrientes (almacén en forma de glucógeno en el músculo y en forma de triglicéridos en el tejido adiposo) (4). Por otra parte, Woo et al. (17) señalan que la suplementación a base de BCAAs no conlleva un aumento en los niveles circulantes de los mismos, de lo que se deriva que su consumo dietético no causaría una elevación en individuos con resistencia a la insulina.
En definitiva, aunque la relación entre los BCAAs y la diabetes tipo 2 es un área activa de investigación, aún no se ha establecido una causa y efecto definitivos ya que también se ha planteado la hipótesis de que la DMT2 en sí misma puede conducir a niveles elevados de BCAAs. Por ello, se necesitan más estudios para comprender completamente la asociación y los mecanismos subyacentes.
[1] La leucina se encuentra en proporciones más elevadas, lo que podría implicar su importancia respecto a los otros dos aminoácidos. Además, se sabe que la abundancia de leucina conlleva la variación de los niveles de valina e isoleucina, aspecto que algunos autores refieren como un efecto “antagonista” de los BCAAs.
[2] Los BCKAs presentan una serie de ventajas respecto a los BCAAs; no aportan nitrógeno, por lo que los pacientes con enfermedades renales se beneficiarían de este aporte ya que, desde el punto de vista nutricional, es necesario que reduzcan la ingesta proteica. Asimismo, son fáciles de preparar y se absorben en el intestino delgado de manera eficaz. Sin embargo, estos BCKAs también presentan algunas limitaciones, como una menor tasa de absorción en comparación a la de los BCAAs, debido a que pueden ser oxidados y empleados en determinados órganos.
[3] En esta reacción, también se forman otros aminoácidos que podrían emplearse como marcadores de un mayor catabolismo de BCAAs, como la glutamina y la alanina.
[4] La BCKDS (en mitocondrias del hígado, músculo y tejido adiposo) se encuentra regulada por distintos factores (1):
- Los factores que regulan a la baja (inhiben) la BCKDH son los siguientes: la fosforilación y los bajos niveles de BCAAs.
- Los factores que regulan al alta (activan) la BCKDH son los siguientes: la desfosforilación y los niveles elevados de BCAAs.
[5] El MTORC1 es un tipo de proteína quinasa implicada en la proliferación celular y en el aumento del tamaño celular como respuesta a factores de crecimiento y disponibilidad de energía y nutrientes. De esta manera, las elevadas concentraciones de BCAAs activan la MTORC1 aumentando la expresión de los genes que codifican los enzimas implicados en la síntesis de lípidos. Además, el MTORC1 es un complejo que se engloba dentro del MTOR, así, aunque este se encargue de promover la síntesis de proteínas, existe otro complejo, denominado MTORC2 que funciona como efector de la vía de señalización insulina/PI3K.
[6] La acumulación en la sangre de los BCAAs y los BCKAs (debuido a un defecto en la BCKDH) y su posterior paso a la orina confiere un olor característico a esta última, por lo que esta patología recibe la denominación de enfermedad del jarabe de arce en la orina. El tratamiento implica limitar en la alimentación la ingesta de los tres BCAAs con el objetivo de prevenir el desarrollo defectuoso del cerebro y el retraso mental que podrían dar lugar a una muerte en la infancia (34)
[7] Concretamente, el elevado flujo de BCAAs en el músculo esquelético implica una acumulación de intermediarios tóxicos lipídicos ya que existe una elevada carga de sustrato en las mitocondrias, lo que implica que al músculo esquelético le cueste más trabajar en la oxidación de ácidos grasos, conduciendo a la disfunción mitocondrial, que a su vez se asocia a la resistencia a la insulina (2,8)
BCAAs y sus aplicaciones clínicas

Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de Madrid. Investigadora del Centro de Estudios Gregorio Marañón.
ABREVIATURAS: Aminoácidos (AA); Branched Chain Amino-Acids, de sus siglas en inglés BCAAs (aminoácidos esenciales de cadena ramificada); proteína quinasa activada por AMP (AMPK); ciclo del ácido tricarboxílico (CAT); diabetes mellitus tipo 2 (DMT2); aminoácido ramificado aminotransferasa (de sus siglas en inglés, branched chain amino acid transferasa, BCAT); complejo de la cetoácido de cadena ramificada deshidrogenasa (de sus siglas en inglés, branched chain α-keto acid dehydrogenase, BCKDH); proteína de unión al elemento de respuesta a glúcidos (ChREBP-β); 3-hidroxi-isobutirato (3-HIB).
GENERALIDADES DE LOS AMINOÁCIDOS ESENCIALES DE CADENA RAMIFICADA (BCAAs)
La valina, leucina e isoleucina conforman los denominados aminoácidos esenciales de cadena ramificada (Branched Chain Amino-Acids, de sus siglas en inglés BCAAs), compuestos obtenidos a partir de alimentos ricos en proteínas, como la carne, huevos, lácteos o legumbres, entre otros. Del total de las proteínas alimentarias, éstos constituyen aproximadamente el 20-25% (los más abundantes) (1) y la proporción en la que se encuentran (Leucina:Isoleucina:Valina) varía entre 2:1:1 o 1,6:2,2:1 (1). En cambio, los BCAAs libres que se encuentran formando parte del pool de aminoácidos del músculo esquelético son de aproximadamente 0,65 milimolar, en una proporción de 2:1:3[1]. En cuanto al total de los aminoácidos esenciales de los mamíferos, el porcentaje de BCAAs representa el 35% (2,3).
Entre sus funciones principales destaca la de ser reguladores clave de la síntesis de proteínas, obviando el metabolismo hepático, por lo que se encuentran rápidamente disponibles en circulación tras su ingesta (4–6). Además, para la síntesis proteica se necesita de la biodisponibilidad de todos los aminoácidos, esto es, en el momento en el que exista una deficiente de algún grupo de aminoácidos (esenciales o no esenciales), no podrá ser llevado a cabo este proceso, metabolizándose el grupo de aminoácidos que se encuentre en exceso y almacenándose en forma de glucógeno (1)
Los BCAAs pueden ser sustratos gluconeogénicos y cetogénicos, concretamente la leucina es cetogénica, la valina es gluconeogénica, mientras que la isoleucina puede ser tanto cetogénica como gluconeogénica (1).
METABOLISMO DE LOS BCAAs
El inicio del metabolismo de los BCAAs comienza en el músculo esquelético y no en el hígado, lo que representa una diferencia con el resto de aminoácidos (1). No obstante, como se ha mencionado anteriormente, los BCAAs obvian el metabolismo hepático debido a la baja actividad de la enzima aminoácido ramificado aminotransferasa (Branched Chain Aminoacid Transferasa, de sus siglas en inglés, BCAT),encargada de catalizar el primer paso de degradación de los BCAAs en α-cetoácidos de cadena ramificada[2] (branched chain ketoacids, de sus siglas en inglés BCKAs). Concretamente, la leucina se transforma en α-cetoisocaproato, la valina en α-cetoisovalerato y la isoleucina en α-cetometilvalerato[3]. Como las BCAT se encuentran principalmente en el músculo esquelético, este tejido representa el lugar más importante para el metabolismo de los BCAAs. Se estima que más de la mitad del total de BCAAs circulantes terminan por entrar en el músculo, una cuarta parte entra en la circulación esplácnica y el resto va a parar al cerebro y otros tejidos. Una vez convertidos en BCKAs, pueden seguir dos vías: reacciones enzimáticas de tipo irreversible o pasar a la circulación para degradarse en otros tejidos (7). No obstante, como el músculo esquelético es un tejido de tipo no gluconeogénico, los BCAAs deben ser eliminados (en forma de BCAAs o en forma de sus metabolitos) en el caso de que no puedan catabolizarse plenamente por los músculos. Seguidamente, actúa la α-cetoácido de cadena ramificada deshidrogenasa (Branched Chain α-Ketoacid DeHydrogenase, de sus siglas en inglés BCKDH), enzima responsable del paso limitante en la velocidad del catabolismo de los BCAAs. Se sabe que en el hígado y en el corazón los niveles de dicha enzima son más altos, mientras que en el músculo esquelético son más bajos. La BCKDH[4] transforma los BCKAs en productos finales (acil-CoA) y el músculo esquelético los libera a la circulación. En este punto, dichos metabolitos pueden seguir dos rutas (1,7): (1); entrar en el Ciclo de Krebs y (2); almacenarse en forma de glucógeno o en forma de triglicéridos.
En resumen, a diferencia de otros aminoácidos en los que su metabolismo tiene lugar principalmente en el hígado, los BCAAs se metabolizan en tejidos periféricos, como el músculo. Por tanto, los BCAAs no se degradan en el hígado. No obstante, es importante señalar que una vez que estos se transforman en BCKAs en otros tejidos, el hígado sí que tiene capacidad para oxidarlos (6,8).
FUNCIONES DE LOS BCAAs
Las funciones principales de estos aminoácidos son las siguientes:
- Son moléculas de señalización implicadas en la síntesis de proteínas (1). Asimismo, los BCAA libres que proceden de la reserva de aminoácidos de los tejidos funcionan como reguladores del metabolismo proteico y energético (3).
- En estados de ayuno, pueden ser degradados para la obtención de energía (1).
- Tras la ingesta, los BCAAs sirven como sustratos para la síntesis proteica (1,9).
- Por tanto, los niveles de BCAAs en sangre postprandiales se corresponden con la ingesta de proteínas alimentarias, a diferencia de los niveles en ayunas, que están regulados por su capacidad de catabolismo.
- Son capaces de incrementar el contenido mitocondrial en tejidos como el músculo esquelético y el tejido adiposo, lo que mejora la capacidad oxidativa (10)
- Se emplean como donantes de grupos amino para sintetizar glutamato en el cerebro (3).
- Pueden oxidarse a través de la señalización del AMPK (proteína quinasa activada por AMP, un sensor del equilibrio energético) para generar energía (en forma de ATP). El carbono procedente de la leucina entra en el ciclo del ácido tricarboxílico (CAT) en forma de acetil-CoA para eliminarse como CO2, mientras que la isoleucina y la valina proporcionan principalmente carbono para la conversión anaplerótica de propionil-CoA en succinil-CoA (4,9,11) (Figura 1).
- Por otro lado, los BCAAs pueden dirigirse a la síntesis de proteínas (en condiciones anabólicas) a través de la activación de la proteína quinasa MTORC1[5] (10), aumentando la expresión de los genes que codifican las enzimas que se encargan de la síntesis de lípidos. Concentraciones elevadas de BCAAs activan permanentemente este complejo, con la consecuente acumulación de triglicéridos en el tejido adiposo, hígado y músculo, lo que contribuye al estado de resistencia a la insulina y diabetes (4,5). Particularmente, de los tres aminoácidos, se conoce que la leucina es el más notable activando la vía de señalización MTORC1 (8).
POSIBLES APLICACIONES CLÍNICAS DE LOS BCAAs. DIABETES MELLITUS TIPO 2, OBESIDAD Y RESISTENCIA A LA INSULINA
La prevalencia de la diabetes mellitus tipo 2 (DMT2) está aumentando en todo el mundo. Las cifras de 2014 (Organización Mundial de la Salud, OMS) indican una elevación de 314 millones de personas desde 1980. El rasgo más característico de la DMT2 es el síndrome metabólico, que aumenta el riesgo de padecer otro tipo de enfermedades, entre las que se citan el cáncer, los trastornos neurodegenerativos y anomalías metabólicas (12–14)
Un fenómeno de importante relevancia en la DMT2 es el denominado resistencia a la insulina. Se trata de un estado en el que se necesita mayor cantidad insulina para conseguir los mismos efectos biológicos producidos por una menor cantidad de insulina en un estado libre de enfermedad. La resistencia a la insulina implica el deterioro de varios de los mecanismos a través de los cuales la insulina ejerce sus efectos metabólicos: cambios en los niveles de proteínas, cambios en las actividades de las enzimas de señalización y de factores de transcripción. Se conoce que existen factores genéticos que predisponen a la DMT2, pero, la mayoría de los individuos obesos no desarrollan diabetes tipo 2, aunque gran parte de diabéticos tipo 2 sean obesos. La genética de la diabetes es compleja e incluye interacciones entre genes variables y factores ambientales, entre los que se cuentan la dieta y el estilo de vida. A este respecto, algunos de los tratamientos propuestos para mejorar la salud de los pacientes diabéticos tipo 2 son la pérdida de peso y el ejercicio. Se ha visto que una pérdida de peso reduce el contenido de triglicéridos en el tejido adiposo, lo que restablece la sensibilidad a la insulina. Desde otro punto de vista, el ejercicio activa la AMPK a través de la conversión de ATP en ADP y AMP, favoreciendo la pérdida de peso.
Relación entre la resistencia a la insulina y los BCAAs
Como se ha mencionado anteriormente, el catabolismo de los BCAAs ocurre principalmente en los tejidos hepático, muscular y adiposo, los cuales contienen la BCAT que produce los BCKAs correspondientes (α-cetoisocaproato, de leucina; α-cetoisovalerato, de valina y α-ceto-metilvalerato, de isoleucina) (Figura 1) cuya reacción es reversible (6). Además, presentan la BCKDH, que cataliza la carboxilación oxidativa de los tres BCKAs produciendo el derivado acil-CoA correspondiente en cada caso, que posteriormente entra en el CAT para su oxidación (4) En definitiva, la degradación de cada uno de los BCAAs lleva a la formación de productos intermedios y finales distintos, aunque compartan varios pasos en el catabolismo (15). No obstante, el catabolismo en cada órgano presenta algunas diferencias por lo que, en el siguiente apartado se exponen losmecanismos propuestos para explicar la relación entre la resistencia a la insulina con los BCAAs.

Figura 1. Metabolismo de los BCAAs. BCAT: Aminoácido ramificado aminotransferasa; BCKDH: Complejo de la α-cetoácido de cadena ramificada deshidrogenasa; CAT: Ciclo del ácido tricarboxilico; 3-Hib: 3-hidroxi-isobutirato.
TEJIDO HEPÁTICO: en este órgano, existe una mayor fosforilación de la BCKDH, que se regula por un factor de transcripción denominado ChREBP-β (proteína de unión al elemento de respuesta a glúcidos), el cual es sensible a la ingesta de hidratos de carbono de tipo simples, como la fructosa. A este respecto, se ha relacionado una dieta rica en fructosa con la elevación de BCAAs en plasma, que posteriormente pasarán al tejido periférico provocando que el catabolismo posterior aumente. En consecuencia, se producirá una cantidad excesiva de acil-CoA, lo que supera el potencial oxidativo de las mitocondrias y perjudica al desarrollo del CAT (ya que se reduce la capacidad del hígado para oxidar los ácidos grasos y la glucosa) provocando que se acumulen unos intermediarios catabólicos, denominados acilcarnitinas, que llevan al estrés oxidativo mitocondrial perjudicando la homeostasis de la glucosa e induciendo la resistencia hepática a la insulina (11). Por otro lado, el exceso de acil-CoA promueve la lipogénesis y gluconeogénesis, lo que genera más resistencia a la insulina. De este mecanismo se deriva la siguiente conclusión, la resistencia a la insulina no es causada directamente por los BCKAs, sino que su descomposición conduce a la acumulación de acilcarnitinas resultando en un estrés oxidativo mitocondrial y causando, en definitiva, la resistencia a la insulina en el hígado (9,13).
TEJIDO ADIPOSO: aunque el mecanismo no es convincente, se sugiere que, si el catabolismo de los BCAAs en el tejido adiposo está inhibido, se promueve la resistencia a la insulina. Esto provoca que los niveles de BCAAs aumenten en plasma, obligando, principalmente, al músculo y al hígado a descomponerlos y, provocando, en última instancia, resistencia a la insulina por el mismo mecanismo que se ha comentado en el anterior caso (13,16). Además, se sabe que la leucina es capaz de activar e inhibir la síntesis y degradación de proteínas en el tejido adiposo a través de la señalización de MTOR (16). Desde otro ángulo, la leucina puede estimular la liberación de insulina en las células β pancreáticas (5) y la liberación de hormonas implicadas en la saciedad y el apetito (ghrelina y leptina), dando como resultado una disminución en el apetito y una reducción en la adiposidad (12). Asimismo, existe otra hipótesis menos estudiada que menciona la disfunción en la enzima deshidrogenasa del tejido adiposo (9), la cual parece contribuir al aumento en las concentraciones plasmáticas de BCAAs. Esta disfunción conduce a la formación de BCKAs que causan estrés oxidativo mitocondrial, de la misma manera que sucede en pacientes que sufren la enfermedad del jarabe de arce en la orina[6] (17).
MÚSCULO ESQUELÉTICO: aunque la expresión de la BCKDH en este órgano es baja, también existe una sobrecarga lipídica que provoca daño mitocondrial y resistencia a la insulina[7]. La insulina impide la degradación proteica, pero, en un estado de resistencia a la insulina, en el que ésta pierde la total capacidad de su función, la degradación proteica en el musculo esquelético no ocurre, con el consecuente aumento en la tasa de aparición de los BCAAs en plasma (9). En otro orden de ideas, el 3-hidroxi-isobutirato (3-HIB), un intermediario que se produce en la descomposición de la valina, promueve la captación de ácidos grasos en el músculo esquelético dando lugar a una acumulación de acilcarnitinas (5,13). Como los músculos no son un tejido gluconeogénico; y la valina y la isoleucina deben convertirse en glucosa, no pueden metabolizarse completamente en este órgano. No obstante, el 3-HIB, que carece de enlace covalente con la Coenzima A (CoA), sale de los miocitos y actúa como sustrato gluconeogénico (ya que puede escapar de la mitocondria, a diferencia de los otros metabolitos catabólicos de los BCAAs que están unidos covalentemente a la CoA) promoviendo el flujo de ácidos grasos al músculo esquelético y acumulándose las especies lipídicas intermediarios que promueven la resistencia a la insulina (1,2,4,11). Otro mecanismo implicado para tratar de explicar por qué el aumento del flujo del catabolismo de BCAAs en el músculo esquelético se relaciona con el desarrollo de la resistencia a la insulina es que el exceso de catabolismo de BCAAs por parte del músculo esquelético termina por consumir la glicina de dentro de la célula, disminuyendo la salida (exportación) de compuestos de acil-glicina, y acumulándose las especies de acil-CoA grasos (2). Por último, se comenta que el incremento en la degradación de BCAAs podría estar relacionado con la resistencia a la insulina por la activación de MTORC1, un regulador de la señalización de la insulina y el metabolismo del músculo esquelético, pero aún se desconoce si la activación de este complejo por los BCAAs es capaz y suficiente para estimular la resistencia a la insulina (2,8).
Con todo lo comentado, en los últimos años los BCAAs y sus derivados se han propuesto como biomarcadores de DMT2 (1,4,13–15,18–30) debido a la elevación en sus niveles plasmáticos en pacientes con dicha enfermedad. Este aumento catabólico de los BCAAs contribuye al aumento de la gluconeogénesis y la intolerancia a la glucosa (3,9,11,19,29,31), lo que constituye un factor de riesgo para desarrollar en un futuro resistencia a la insulina y, posteriormente, DMT2 (5,9,16,21,29,32,33).
A este respecto, numerosos autores señalan que las concentraciones plasmáticas de BCAAs constituyen un biomarcador de detección temprana para detectar una posible diabetes, mucho antes de que la insuficiencia en las células β pancreáticas, responsables de segregar la insulina, se produzca. Concretamente, se sugiere que los niveles de BCAAs predicen el riesgo de DMT2 incidente hasta doce años antes de su manifestación (5,11,16,19,20).
No obstante, aún existe mucha controversia acerca de si los niveles elevados de BCAAs se consideran biomarcadores que se alteran como consecuencia de la resistencia a la insulina o si, por el contrario, su incremento contribuye a la aparición de la resistencia a la insulina (1,2). El principal problema reside en que los estudios científicos aún no dan resultados demasiado concluyentes, esto es, se desconoce si una reducción dietética de los BCAAs (al ser estos aminoácidos esenciales y depender de la fuente dietética) podría revertir la resistencia a la insulina (25). En principio, se pensaba que la elevación de BCAAs era consecuencia de un aumento en la ingesta proteica, pero estudios epidemiológicos han señalado que el aumento del consumo diario se debe al incremento de los hidratos de carbono más que de las proteínas (17) ya que una dieta con alto aporte de proteína animal o vegetal no aumenta la resistencia a la insulina (17,25), probablemente porque cualquier aumento excesivo en la ingesta de proteínas conlleva un posterior catabolismo, al contrario de lo que ocurre con los otros grupos de macronutrientes (almacén en forma de glucógeno en el músculo y en forma de triglicéridos en el tejido adiposo) (4). Por otra parte, Woo et al. (17) señalan que la suplementación a base de BCAAs no conlleva un aumento en los niveles circulantes de los mismos, de lo que se deriva que su consumo dietético no causaría una elevación en individuos con resistencia a la insulina.
En definitiva, aunque la relación entre los BCAAs y la diabetes tipo 2 es un área activa de investigación, aún no se ha establecido una causa y efecto definitivos ya que también se ha planteado la hipótesis de que la DMT2 en sí misma puede conducir a niveles elevados de BCAAs. Por ello, se necesitan más estudios para comprender completamente la asociación y los mecanismos subyacentes.
[1] La leucina se encuentra en proporciones más elevadas, lo que podría implicar su importancia respecto a los otros dos aminoácidos. Además, se sabe que la abundancia de leucina conlleva la variación de los niveles de valina e isoleucina, aspecto que algunos autores refieren como un efecto “antagonista” de los BCAAs.
[2] Los BCKAs presentan una serie de ventajas respecto a los BCAAs; no aportan nitrógeno, por lo que los pacientes con enfermedades renales se beneficiarían de este aporte ya que, desde el punto de vista nutricional, es necesario que reduzcan la ingesta proteica. Asimismo, son fáciles de preparar y se absorben en el intestino delgado de manera eficaz. Sin embargo, estos BCKAs también presentan algunas limitaciones, como una menor tasa de absorción en comparación a la de los BCAAs, debido a que pueden ser oxidados y empleados en determinados órganos.
[3] En esta reacción, también se forman otros aminoácidos que podrían emplearse como marcadores de un mayor catabolismo de BCAAs, como la glutamina y la alanina.
[4] La BCKDS (en mitocondrias del hígado, músculo y tejido adiposo) se encuentra regulada por distintos factores (1):
- Los factores que regulan a la baja (inhiben) la BCKDH son los siguientes: la fosforilación y los bajos niveles de BCAAs.
- Los factores que regulan al alta (activan) la BCKDH son los siguientes: la desfosforilación y los niveles elevados de BCAAs.
[5] El MTORC1 es un tipo de proteína quinasa implicada en la proliferación celular y en el aumento del tamaño celular como respuesta a factores de crecimiento y disponibilidad de energía y nutrientes. De esta manera, las elevadas concentraciones de BCAAs activan la MTORC1 aumentando la expresión de los genes que codifican los enzimas implicados en la síntesis de lípidos. Además, el MTORC1 es un complejo que se engloba dentro del MTOR, así, aunque este se encargue de promover la síntesis de proteínas, existe otro complejo, denominado MTORC2 que funciona como efector de la vía de señalización insulina/PI3K.
[6] La acumulación en la sangre de los BCAAs y los BCKAs (debuido a un defecto en la BCKDH) y su posterior paso a la orina confiere un olor característico a esta última, por lo que esta patología recibe la denominación de enfermedad del jarabe de arce en la orina. El tratamiento implica limitar en la alimentación la ingesta de los tres BCAAs con el objetivo de prevenir el desarrollo defectuoso del cerebro y el retraso mental que podrían dar lugar a una muerte en la infancia (34)
[7] Concretamente, el elevado flujo de BCAAs en el músculo esquelético implica una acumulación de intermediarios tóxicos lipídicos ya que existe una elevada carga de sustrato en las mitocondrias, lo que implica que al músculo esquelético le cueste más trabajar en la oxidación de ácidos grasos, conduciendo a la disfunción mitocondrial, que a su vez se asocia a la resistencia a la insulina (2,8)
Otras Noticias

Encuentros con expertos: La sanidad española mirando al futuro
“La Sanidad española mirando al futuro”, un ciclo de encuentros con expertos que muestra casos…

Triptófano y sus metabolitos
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense…

Glutamina: Metabolismo, ejercicio físico y suplementación
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

La colina como biomarcador
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de…
Noticias relacionadas

Encuentros con expertos: La sanidad española mirando al futuro
“La Sanidad española mirando al futuro”, un ciclo de encuentros con expertos que muestra casos…

Triptófano y sus metabolitos
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense…

Glutamina: Metabolismo, ejercicio físico y suplementación
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología-Toxicología. Departamento de Medicina Legal, Psiquiatría y Patología.…

La colina como biomarcador
Celia Chicharro Miguel. Investigadora Doctorado. Laboratorio de Biopatología. Departamento de Medicina Legal, Psiquiatría y Patología. Universidad Complutense de…




